Электродные потенциалы и гальванические элементы
Система, состоящая из металла, погруженного в раствор электролита, называется электродом. Рассмотрим равновесие, устанавливающееся после погружения металлической пластинки в раствор соли этого металла. С участием молекул воды протекает обратимый процесс:
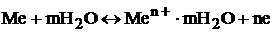 .
.
Если концентрация ионов металла в растворе меньше равновесной, то при погружении металла в раствор равновесие смещается вправо, что приводит к отрицательному заряду на металле по отношению к раствору (рис. 1). Если малоактивный металл погружен в раствор соли с концентрацией больше равновесной, то происходит переход ионов из раствора на металл, который заряжается положительно. В любом случае возникает двойной электрический слой, и появляется разность электрических потенциалов. Абсолютное значение разности потенциалов на границе двух фаз разной природы металл – электролит измерить нельзя, однако можно измерить разность потенциалов двух различных электродов. Для этого необходимо собрать электрохимическую ячейку или гальванический элемент.
Гальваническим элементом называется многофазная система, состоящая по меньшей мере из двух электродов (полуэлементов). В качестве примера рассмотрим цинк-серебряный гальванический элемент (рис. 2), состоящий из цинкового и серебряного полуэлементов.
Гальванический элемент состоит из растворов, содержащих ионы Zn2+ и Ag+, разделенных пористой диафрагмой для того, чтобы обеспечить протекание тока без смешения растворов. В каждый из растворов опущен электрод из соответствующего металла. Границу раздела фаз металл – раствор обозначают символом «/», а электролитический контакт растворов – «//». Таким образом, схему рассматриваемого элемента можно представить в виде
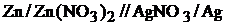
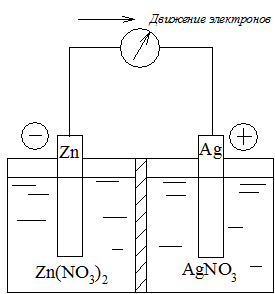
Рис. 2. Схема цинк-серебряного гальванического элемента
В цинковом полуэлементе протекает реакция окисления, электрод называют анодом. При протекании тока масса анода уменьшается за счет его растворения.
Zn « Zn2+ + 2e.
В серебряном полуэлементе протекает реакция восстановления, электрод называют катодом. При протекании тока масса катода увеличивается за счет осаждения на его поверхности металла.
2 Ag+ + 2e « Ag
Суммарная реакция получается сложением полурекций:
Zn + 2Ag+ « Zn2+ + 2 Ag
Направление протекания самопроизвольного процесса, можно определить из величин электродных потенциалов полуэлементов.
Электродный потенциал это разность потенциалов гальванического элемента, состоящего из исследуемого электрода и электрода сравнения, при условии, что ток во внешней цепи стремится к нулю . Измеренную в таких условиях разность потенциалов называют электродвижущей силой (коротко – э.д.с.).
Стандартным электродом сравнения служит стандартный водородный электрод. Это газовый электрод, состоящий из платиновой проволоки, покрытой слоем платиновой черни, находящийся в атмосфере водорода под давлением 1,013×105 Па (1 атм) и погруженный в раствор с активностью ионов Н+ равной 1,0 моль/дм3. В соответствии с международным соглашением потенциал такого электрода условно принят за нуль при любых температурах.
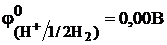
Таким образом, для измерения электродного потенциала необходимо собрать гальванический элемент, состоящий из исследуемого электрода (всегда записывают справа) и стандартного водородного электрода (всегда записывают слева). Например, для цинкового электрода
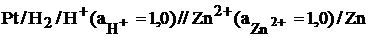
Э.д.с. такого гальванического элемента, называют стандартным электродным потенциалом если измерения проводят при стандартных условиях (активности всех компонентов равны 1,00 моль/дм3, Т = 298 К)
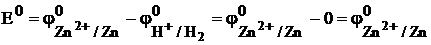 .
.
Уравнение Нернста. Потенциал электрода зависит от состава электролита и температуры в соответствии с уравнением Нернста:
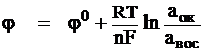
где φ – потенциал в Вольтах, φо-стандартный электродный потенциал; aок, aвос – активности потенциалопределяющих ионов в окисленном и восстановленном состоянии; n – число электронов, принимающих участие в данной электродной реакции; F = 96480 Кл/моль (постоянная Фарадея); R - универсальная газовая постоянная; Т – температура, К.
При Т = 298 К для металлических электродов уравнение Нернста имеет вид:
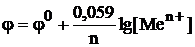
Таблица стандартных электродных потенциалов. Стандартные электродные потенциалы для различных электродных реакций приведены в специальных таблицах в порядке их возрастания. Величина стандартного электродного потенциала характеризует стремление электродной реакции протекать в направлении восстановления иона. Чем ниже расположена реакция в таблице, тем вероятней протекание реакции восстановления. Восстановленная форма любого элемента (иона) расположенного выше будет восстанавливать окисленную форму элемента (иона), имеющего более положительный потенциал.
Ряд напряжения металлов. Стандартные электродные потенциалы для различных металлов, расставленные в порядке возрастания, называют рядом напряжения металлов, который совпадает с рядом активностей металлов (Приложение 1). Этот ряд позволяет делать практически важные выводы об относительной окислительно-восстановительной способности металлов:
- металлы с более отрицательным потенциалом способны вытеснить (восстановить) из водных растворов солей металлы с более положительным потенциалом;
- металлы с отрицательными электродными потенциалами могут вытеснять водород из кислот, металлы с j0 > 0 этим свойством не обладают.
