Металлоорганические соединения.
Металлоорганические соединения − это соединения содержащие связь углерод − металл.
Необходимо обратить внимание на способы получения магнийорганических соединений. RMgHal (реактивы Гриньяра) обладают весьма большой реакционной способностью. С их помощью аналитически определяется наличие в молекуле подвижного атома водорода:
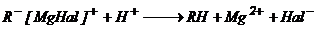
Эта реакция протекает при взаимодействии реактива Гриньяра с ацетиленом, кислотами, водой, аминами, спиртами и др. Среди реакций присоединения наиболее важны:
- взаимодействие реактива Гриньяра с карбонилсодержащими соединениями (альдегидами, кетонами и эфирами карбоновых кислот);
- реакция с диоксидом углерода с последующим гидролизом полученного продукта до карбоновых кислот (используется как метод удлинения углеродных цепей).
Спирты
Спирты − гидроксильные производные углеводородов. Изомерия спиртов зависит от строения углеродной цепи и положения гидроксила в цепи. Необходимо изучить способы получения спиртов: гидролизом галогеналкилов:
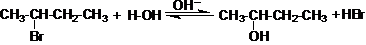
2-бромбутан 2-бутанол (втор.бутиловый спирт)
При действии магнийорганических соединений на альдегиды, кетоны и сложные эфиры:
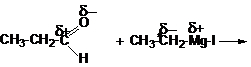
пропаналь этилмагниййодид
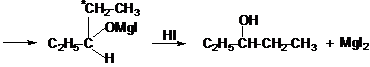
3-пентанол
Гидратация этиленовых углеводородов, восстановление альдегидов, кетонов и сложных эфиров.
Для спиртов характерны реакции нуклеофильного замещения, отщепления, окисления. Особенность реакций SN у спиртов состоит в том, что они протекают только в кислой среде, т.к. протонирование гидроксильной группы способствует ее отщеплению.
Реакция со вторичными и третичными спиртами протекает в соответствии с механизмом SNI в две стадии: в первой, медленной стадии, происходит отщепление воды и образование стабильного карбкатиона; во второй − карбкатион быстро взаимодействует с нуклеофилом:
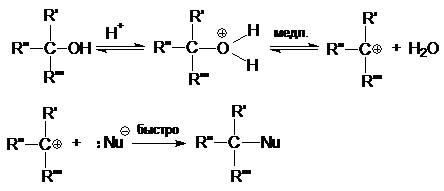
Реакция с первичными спиртами протекает в соответствии с механизмом SN2 в одну стадию. Одновременно разрывается связь С-О и образуется связь С-Nu.
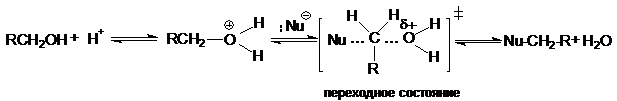
Реакции отщепления воды могут проходить по механизмам ЕI и Е2, в зависимости от строения спирта и условий реакции. Реакция, согласно правилу Зайцева, идет в сторону образования наиболее устойчивого олефина (наиболее замещенного этилена).
Для реакций спиртов характерны также некоторые гомолитические реакции, например, окисление и дегидрирование, которые осуществляются на гетерогенных катализаторах типа металлов или их оксидов. При изучении курса необходимо обратить внимание на эти реакции, в связи с их промышленным значением.
Химические свойства многоатомных спиртов (гликоли, глицерин) повторяют свойства одноатомных.
Фенолы
Ароматические оксисоединения разделяются на две группы ароматические спирты и фенолы. Ароматические спирты содержат гидроксильную группу в боковой цепи и по многим свойствам они идентичным алифатическим спиртам:
В фенолах гидроксильная группа связана непосредственно с атомом углерода бензольного ядра:
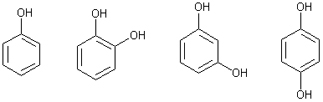
Фенол Пирокатехин Резорцин Гидрохинон
Способы получения. Наиболее прогрессивным способом получения фенола является кумольный, основанный на реализации следующих стадий:
1. Окисление изопропилбензола (кумола) в гидропероксид
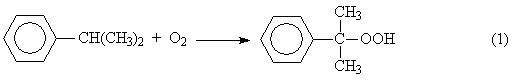
2. Разложение получаемого гидропероксида на фенол и ацетон
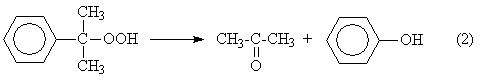
Суммируя уравнения (1) и (2) получаем результирующее уравнение процесса
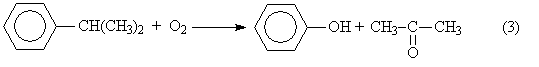
Получение из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при дальнейшей обработке которого кислотой образуется фенол:
С6Н5−Сl + 2NaOH → C6H5−ONa + NaCl + Н2О.
Получение из ароматических сульфокислот. Реакция проводится при сплавлении сульфокислот со щелочами:
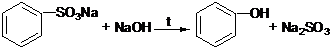
В фенолах свободная р-электронная пара атома кислорода гидроксила делокализуется за счет сопряжения ее с электронной системой кольца. Это приводит к ослаблению связи О-Н и обусловливает кислотные свойства фенолов. Фенолы ведут себя как слабые кислоты. Они взаимодействуют со щелочами, образуя феноляты:
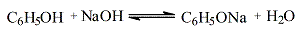
Кислотные свойства фенолов усиливаются при наличии в их кольце электроноакцепторных заместителей, так, тринитрофенол (пикриновая кислота) является сильной кислотой.
К реакциям фенольного гидроксила относятся также реакции алкилирования по кислородному атому с помощью галогенпроизводных или диазометана (CH2N2) и реакция ацилирования с помощью ангидридов или галогенангидридов кислот. Фенольный гидроксил ускоряет реакции электрофильного замещения в ароматическом кольце: галогенирование, нитрование, сульфирование. По такому же механизму протекают реакции конденсации фенола с алифатическими альдегидами в щелочной и кислой среде. На использовании этих реакций основано получение фенолформальдегидных смол резольного и новолачного типов.
5.5.Простые эфиры
Простые эфиры общей формулы R-O-R' можно представить как соединения, образованные замещением гидроксильного водорода спиртов одним алкильным (арильным) радикалом. Изомерия простых эфиров зависит от изомерии радикалов, связанных с атомом кислорода. Простые эфиры получают дегидратацией спиртов (под действием сильных протонных кислот) или взаимодействием алкоголятов с галогеналкилами. Простые эфиры − нейтральные и малоактивные соединения. Они разлагаются под действием концентрированных кислот (Н2SО4, НХ), а также подвергаются расщеплению под действием щелочных металлов, при нагревании.
К циклическим эфирам относится оксид этилена. Цикл напряжен,
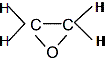
поэтому реакции присоединения к оксиду этилена легко протекают с разрывом связи С-О. При этом активный атом водорода присоединяющейся молекулы, идет к атому кислорода, а остальная ее часть − к атому углерода оксидного кольца. Оксид этилена − весьма реакционноспособное соединение и широко используется в органическом синтезе.
Альдегиды и кетоны
Альдегидами и кетонами называют производные углеводородов, содержащие карбонильную группу (1). Различие между альдегидами и кетонами состоит в том, что в альдегидах одним из заместителей при карбонильной группе является атом водорода (2):

1 2
Изомерия альдегидов связана со строением радикалов. Изомерия кетонов связана со строением радикалов и положением карбонильной группы в углеродной цепи.
Высокая реакционная способность альдегидов и кетонов обусловлена полярностью и легкой поляризуемостью карбонильной группы вследствие различной электроотрицательности атомов углерода и кислорода:

Из способов получения карбонильных соединений следует изучить оксосинтез (условия), окисление спиртов, реакцию Кучерова (стадии, условия), гидролиз дигалогенпроизводных углеводородов.
По карбонильному атому углерода альдегидов и кетонов происходит нуклеофильное присоединение воды, спиртов, синильной кислоты, гидросульфита (бисульфита) натрия, реактивов Гриньяра и мезомерного карбаниона в реакциях альдольной конденсации. Реакции нуклеофильного присоединения ускоряются кислотами и основаниями, но сильные нуклеофильные агенты присоединяются без катализатора (NaHSO3, NH2OH, RМgHal). Кетоны менее реакционноспособны в этих реакциях, чем альдегиды, т.к. присутствие дополнительной алкильной группы в кетоне понижает частичный положительный заряд на карбонильном атоме углерода, а также вызывает пространственные затруднения при атаке этого атома углерода.
При кислотном катализе протон присоединяется к карбонильному атому кислорода с образованием активного карбкатиона:
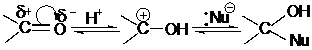
карбкатион
К реакциям присоединения относятся реакции восстановления альдегидов и кетонов.
Следует обратить внимание на высокую реакционную способность водородного атома, находящегося в a-положении, к альдегидной группе. Реакция альдольной конденсации имеет большое значение при образовании сахаристых веществ.
Ароматические альдегиды и кетоны − это соединения с карбонильной группой, связанной с атомом углерода бензольного кольца или боковой цепи.
Ароматические альдегиды и кетоны получают гидролизом геминальных арилдигалогенидов; окислением углеводородов и ароматических спиртов; по реакции Гаттермана-Коха (прямое введение альдегидной группы); при конденсации ароматических альдегидов по Кляйзену и по реакции Фриделя-Крафтса (ацилирование):
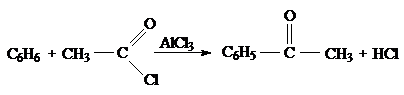
Ароматические альдегиды вступают в большинство реакций, свойственных альдегидам алифатического ряда. Альдегидная группа является электроноакцепторной группой и дезактивирует ароматическое кольцо в реакциях электрофильного замещения (SЕ), способствуя м-ориентации.
Ароматические кетоны менее реакционноспособны, чем кетоны алифатического ряда. Они вступают в реакции с гидроксиламином, фенилгидразином, в реакции со сложными эфирами, ангидридами кислот и т.д. Несимметричные алкилароматические и ароматические кетоны с гидроксиламином образуют по два изомерных оксима − син- и анти-:
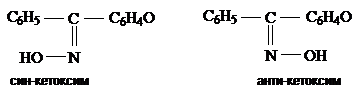
Более стойкой является анти-форма. Под действием сильных минеральных кислот оксимы перегруппировываются в амиды кислот. Эта перегруппировка называется перегруппировкой Бекмана. Кетонная группы дезактивирует кольцо в реакциях электрофильного замещения и является для них м-ориентантом.
Карбоновые кислоты
Карбоновыми кислотами называют производные углеводородов, в молекулах которых атом водорода замещен на карбоксильную группу:
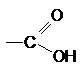
Изомерия кислот обусловлена строением углеводородного радикала. Необходимо изучить способы получения кислот: окислением первичных спиртов и альдегидов, синтезом через металлоорганические соединения, оксосинтезом.
Кислотный характер карбоновых кислот объясняется взаимным влиянием атомов в карбоксильной группе: в ней электронная плотность смещена в сторону наиболее электроноакцепторного атома кислорода:
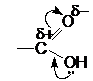
Это ослабляет связь между кислородом и водородом и облегчает диссоциацию кислоты.
Необходимо изучить получение и основные свойства галогенангидридов, сложных эфиров, ангидридов кислот, амидов, нитрилов кислот. Галогенангидриды обладают высокой реакционной способностью в реакциях нуклеофильного замещения: со спиртами и аминами они образуют соответственно сложные эфиры и амиды.
Ароматические карбоновые кислоты − это соединения, содержащие одну или несколько карбоксильных групп, связанных с ароматическим кольцом молекулы. Кислоты, содержащие карбоксильные группы в боковой цепи, рассматриваются как жирно-ароматические.
Ароматические карбоновые кислоты могут быть получены окислением ароматических углеводородов. Жирно-ароматические карбоновые кислоты могут быть получены всеми общими способами, известными для кислот алифатического ряда: гидролизом геминальных тригалогенпроизводных углеводородов и нитрилов, реакцией металлорганических соединений с СО2.
Свойства ароматических кислот идентичны свойствам алифатических кислот. Они образуют: ангидриды, галогенангидриды, амиды кислот, сложные эфиры, нитрилы, надкислоты, пероксиды.
Карбоксильная группа, являясь электроноакцепторной, дезактивирует ароматическое кольцо в реакциях электрофильного замещения (SЕ) и ориентирует заместители в м-положения.
Нитросоединения
Нитросоединения характеризуются наличием нитрогруппы -NO2. Ей изомерна структура -О-NO (эфиры азотистой кислоты). В зависимости от строения атома углерода, с которым связана нитрогруппа, различают первичные (1), вторичные (2), третичные (3) нитросоединения.
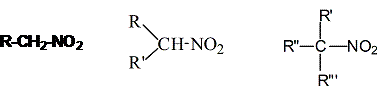
1 2 3
Нитрогруппа может быть представлена в виде гибрида двух эквивалентных резонансных структур:
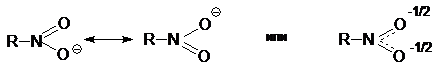
В гибридной структуре атом азота несет полный положительный заряд, а каждый атом кислорода − половину отрицательного заряда. Это обуславливает сильный отрицательный индуктивный эффект нитрогруппы -INO2и высокую полярность нитросоединений.
Нитросоединения получают в промышленности нитрованием алканов парами азотной кислоты при 250…500 оС. Другие способы получения алифатических нитросоединений основаны на реакции алкилгалогенидов с нитритом натрия в растворе диметилсульфоксида или диметилформамида. Вместо нитрита натрия часто применяют азотистокислое серебро, обычно в растворе диэтилового эфира.
Вследствие сильных электроноакцепторных свойств нитрогруппы a-метиленовое -СН2- и метиленовое -СН- звенья первичных и вторичных нитроалканов обладают подвижными атомами водорода. Это проявляется прежде всего в том, что соединения с нитрогруппой при первичном или вторичном атомах углерода реагирует со щелочью в таутомерной форме. Пара электронов, связывающая атом углерода с уходящим протоном, перемещается, осуществляя связь атомов углерода и азота. При этом заряд аниона сосредотачивается на атоме кислорода и образуются соли так называемых ацинитросоединений:

Ацинитроформа характеризуется кислыми свойствами и в щелочной среде образует соль. При подкислении равновесие реакций сдвигается влево. Подвижность атомов водорода первичных и вторичных нитросоединений сказывается на их отношении к азотистой кислоте (качественная реакция). Первичные и вторичные нитросоединения конденсируются в присутствии щелочей с альдегидами, образуя нитроспирты (нуклеофильное присоединение):
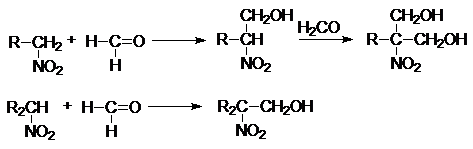
Нитроалканы используются в технике как растворители, для производства альдегидов, кислот, взрывчатых веществ, в реактивной технике, резиновой промышленности (вулканизаторы), при изготовлении пластмасс и т.д.
Различают два типа ароматических нитросоединений:
- с нитрогруппой, связанной с атомом углерода ароматического кольца;
- с нитрогруппой в боковой цепи.
Для введения нитрогруппы в ароматическое кольцо наиболее широко используется прямое нитрование. Реакция нитрования ароматического кольца нитрующей смесью протекает по механизму электрофильного замещения.
Получение нитросоединений с нитрогруппой в боковой цепи осуществляется теми же методами, что и для соединений жирного ряда.
Наиболее важным свойством нитросоединений обоих типов является их способность восстанавливаться до первичных аминов. Результат восстановления зависит от характера среды: в кислой среде сразу образуется NH2 - группа (быстрое протекание промежуточных стадий), в нейтральной и щелочной средах восстановление происходит ступенчато, с образованием промежуточных продуктов.
Обладая сильными электроноакцепторными свойствами, нитрогруппа оказывает м-ориентирующее влияние и дезактивирует кольцо в реакциях электрофильного замещения (у ароматических нитропроизводных скорость этих реакций ниже, чем у бензола). Напротив, нитрогруппа увеличивает скорость реакций нуклеофильного замещения и ориентирует нуклеофильные заместители в о- и п-положения кольца.
Ароматические нитросоединения с нитрогруппой в боковой цепи проявляют в основном свойства нитросоединений алифатического ряда.
Амины
Амины − соединения, образующиеся в результате замещения водородных атомов в аммиаке алкильными или арильными радикалами. В зависимости от того, сколько атомов водорода замещено радикалами, различают первичные (RNH2), вторичные (R2NH) и третичные (R3N) амины. Изомерия аминов зависит от положения аминогруппы и строения радикалов, связанных с атомом азота.
Первичные амины получают восстановлением нитросоединений, нуклеофильным замещением галогена в галогеналкилах или ОН-группы в спиртах под действием аммиака. Вторичные и третичные амины получают алкилированием первичных аминов (по реакции Гофмана).
Аминогруппа весьма реакционноспособна благодаря наличию связанных с атомом азота подвижных атомов водорода (реакции с азотистой кислотой, алкилирование, ацилирование и др.). Подобно аммиаку, амины проявляют оснόвные свойства, что обусловлено наличием у атома азота неподеленной электронной пары. Амины − органические основания.
В зависимости от положения аминогруппы в ароматических соединениях различают:
- чисто ароматические амины, когда аминогруппа непосредственно соединена с атомом углерода бензольного кольца;
- амины с аминогруппой в боковой цепи, обладающие свойствами алифатических аминов.
Ароматические амины могут быть первичными, вторичными и третичными. Вторичные и третичные ароматические амины могут быть чисто ароматическими или смешанными − жирно-ароматическими. Простейший ароматический амин − анилин не имеет изомеров. Его гомологи существуют в изомерных формах. Необходимо изучить способы получения первичных, вторичных и третичных аминов.
Ароматические амины имеют менее выраженный основный характер, чем жирные амины. Это объясняется взаимодействием неподеленной пары р-электронов атома азота с p-электронной системой кольца (p-, р-сопряжение). Такое сопряжение приводит к делокализации неподеленной пары электронов и понижает ее способность присоединять протон.
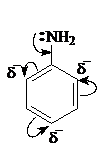 Ароматические амины вступают в химические превращения с участием аминогруппы для ароматического ядра. В первом случае необходимо обратить внимание на реакцию с азотистой кислотой. Первичные ароматические амины при взаимодействии с азотистой кислотой образуют диaзосоединения, существующие в кислой среде в форме солей диазония:
Ароматические амины вступают в химические превращения с участием аминогруппы для ароматического ядра. В первом случае необходимо обратить внимание на реакцию с азотистой кислотой. Первичные ароматические амины при взаимодействии с азотистой кислотой образуют диaзосоединения, существующие в кислой среде в форме солей диазония:
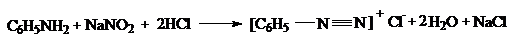
Вторичные ароматические амины образуют с азотистой кислотой нитрозоамины, легко перегруппировывающиеся в п-нитрозоамины, а третичные − сразу дают п-нитрозоамины. В реакциях электрофильного замещения в ароматическое ядро аминогруппа оказывает п-, о-ориентирующее действие, поскольку образующиеся п- и о- s-комплексы сильно стабилизированы за счет сопряжения р-электронов аминогруппы с вакантной р-орбиталью s-комплексов через систему сопряженных связей ароматического ядра.
Ароматические амины легко окисляются по аминогруппе; поэтому, для проведения реакций, в которых окисление является побочным процессом, ее необходимо защитить. Обычно, это выполняется путем ацилирования аминогруппы органическими кислотами, их ангидридами или галогенангидридами. После проведения нужной реакции, защищающую группу удаляют омылением:
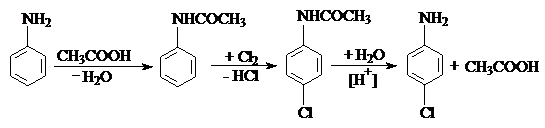
Подобная защита необходима в случае получения монозамещенных продуктов, т.к. аминогруппа оказывает сильное активирующее действие.
Амины используют в синтезе лекарственных препаратов, красителей, в производстве ПАВ и синтетических волокон, собирателей при флотации.
Диазо- и азосоединения
Ароматическими диазосоединениями называют различные по строению, однако легко взаимопревращаемые соединения: соли диазония 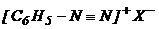 , диазогидраты
, диазогидраты 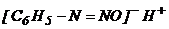 , диазотаты
, диазотаты 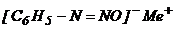 . Реакцию образования диазосоединений из аминов называют диазотированием. Диазотирование проводят действием на водный раствор амина азотистой кислоты, получаемой из ее солей, в присутствии избытка минеральной кислоты (2,5 эквивалента):
. Реакцию образования диазосоединений из аминов называют диазотированием. Диазотирование проводят действием на водный раствор амина азотистой кислоты, получаемой из ее солей, в присутствии избытка минеральной кислоты (2,5 эквивалента):
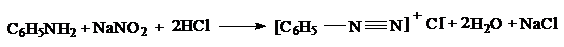
Превращения диазосоединений могут протекать:
- с выделением азота;
- без выделений азота.
Первый тип реакции используют для получения ароматических соединений различных классов с функцией в ароматическом ядре. Ко второму типу реакций относятся реакции восстановления, окисления и азосочетания. Реакции азосочетания легко идут при действии солей диазония на фенолы в слабощелочном растворе и ароматические амины в слабокислом растворе. Эти реакции протекают по механизму электрофильного замещения. Азосоединения лежат в основе обширной группы красителей, цвет и оттенки которых создаются сочетанием различных диазо- и азосоставляющих. Эти красители отличаются разнообразием окраски и обладают хорошими окрашивающими свойствами.
