АЛКЕНЫ: определение, изомерия, номенклатура
Углеводороды, в молекулах которых помимо одинарных углерод-углеродных σ-связей имеются углерод-углеродные π-связи, называются непредельными.
Углеводороды, содержащие одну углерод-углеродную π-связь (то есть двойную связь), называются алкенами или олефинами. Общая формула членов гомологического ряда этиленовых углеводородов СnH2n. Родоначальник ряда − этилен СН2=СН2.
Изомерия и номенклатура
В соответствии с правилами ИЮПАК при построении названий алкенов наиболее длинная углеродная цепь, содержащая двойную связь, получает название соответствующего алкана, в котором суффикс «ан» заменен на «ен». Эта цепь нумеруется таким образом, чтобы углеродные атомы, участвующие в образовании двойной связи, получили номера, наименьшие из возможных. Радикалы называются и нумеруются, как и в случае алканов:
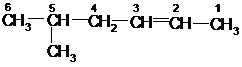 5-метил-2-гексен
5-метил-2-гексен
Углеводородные радикалы, образованные из алкенов, получают суффикс –енил, в общем случае –алкенил. Нумерация в сложных радикалах начинается от углеродного атома, имеющего свободную валентность. Для простейших радикалов используются тривиальные названия:
 этенил 2-пропенил 1-метилэтенил 2-метил-2-бутенил
этенил 2-пропенил 1-метилэтенил 2-метил-2-бутенил
(винил) (аллил) (изоаллил)
Структурная изомерия начинается в этом ряду, как и в ряду предельных углеводородов, с члена ряда С4, однако число изомеров значительно больше. Наряду с изомерией, связанной со строением углеродной цепи, в ряду олефинов наблюдается структурная изомерия, обусловленная положением двойной связи в цепи.
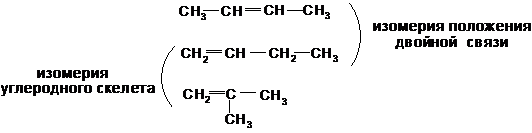
Кроме того, в ряду олефинов имеет место пространственная (геометрическая), так называемая цис-, транс- изомерия (E, Z).
Вращение вокруг связи С─С в молекулах алканов требует малой затраты энергии (8-16 кДж/моль). Для этого достаточно теплового движения молекул.
Вращение же фрагментов С=С относительно друг друга требует разрыва π-связи и затраты 272 кДж/моль. В связи с этим соединения, содержащие у атомов углерода, связанных двойной связью, хотя бы по одному разному заместителю, могут существовать в изомерных формах. Эти изомеры различаются пространственным расположением заместителей относительно друг друга. Если заместители расположены по одну сторону от двойной связи, то такой изомер называется цис-изомером, и транс-изомером, если по разные стороны:

(Z) цис-2-бутен (Е) транс-2-бутен
В сложных молекулах понятие цис- и транс- становятся неопределенными. В этих случаях пользуются общей ZЕ-системой обозначений. Составлена таблица возрастающего старшинства групп. Если старшая группа у одного из углеродных атомов находится по одну сторону со старшей группой у другого атома углерода, то этот изомер называется Z-изомером.
Способы получения
Олефины встречаются в некоторых сортах нефти. В чистом виде из нефти выделены углеводороды от С6Н12 до С13Н26. Алкены, в виде сложных смесей получаются при крекинге нефти.
В технике, кроме того, применяется получение этиленовых углеводородов дегидрированием предельных углеводородов. Катализатором этого процесса служит окись хрома:
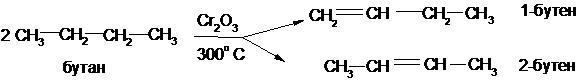 В лаборатории этиленовые углеводороды получают следующими способами:
В лаборатории этиленовые углеводороды получают следующими способами:
1. При действии спиртовых растворов едких щелочей на галогенопроизводные отщепляется галогеноводород и образуется двойная связь. Порядок отщепления галогеноводорода в большинстве случаев определяется правилом Зайцева: при образовании галогеноводорода и воды наиболее легко отщепляется водород от наименее гидрогенизированного соседнего атома углерода:
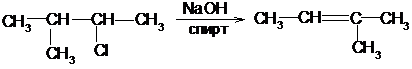
2-метил-3-хлорбутан 2-метил-2-бутен
2. При действии на спирт дегидратирующих средств:
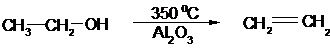
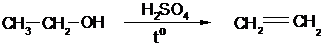
этилен
3. При действии Zn или Mg на дигалогенопроизводные с двумя атомами галогена у соседних атомов углерода (вицинальные дигалогенопроизводные):
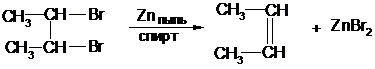
2,3-дибромбутан 2-бутен
4. Гидрированием ацетиленовых или диеновых углеводородов. Алкины гидрируются над катализаторами с пониженной активностью (Fe или платина и Рd, «отравленные» серой, Na в аммиаке):
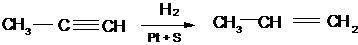
пропин пропен
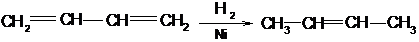
1,3-бутадиен 2-бутен
Физические свойства
Физические свойства алкенов подобны свойствам соответствующих алканов. Низшие алкены (С2 – С4 ) являются газами, средние алкены (начиная с С5 до С17) жидкостями, не смешивающиеся с водой. Высшие алкены – твердые вещества.
Олефины с нормальной цепью углеродных атомов кипят при более высокой температуре, чем их изомеры с разветвленной цепью. Перемещение двойной связи в центр молекулы вызывает повышение температуры кипения и плавления алкена. Цис-изомеры обычно кипят при более высокой, а плавятся при более низкой температуре, чем транс-изомеры.
Плотность олефинов меньше единицы, но больше, чем плотность соответствующих парафинов. В гомологическом ряду она увеличивается. Для олефинов характерны более высокие показатели преломления света, чем для парафинов.
Следует заметить, что этиленовые углеводороды хорошо растворяются в растворах некоторых солей тяжелых металлов (Сu2Cl2), образуя с ними комплексные соединения.
Химические свойства
Главным структурным элементом, определяющим реакционную способность алкенов, является двойная связь, представляющая собой сочетание σ- и π-связей (sp2-гибридизация). При сравнении структурных и энергетических параметров молекул алканов и алкенов видно, что двойная связь значительно короче и прочнее одинарной связи. Однако энергия двойной связи меньше, чем энергия двух ординарных, на 92,1 кДж/моль. Поэтому двойная связь легко переходит в две ординарные σ-связи путем присоединения по месту двойной связи двух атомов или атомных групп.
Таким образом, для олефинов наиболее типичны реакции присоединения. Однако следует иметь в виду, что олефины способны и к реакциям замещения, причем некоторые из них идут значительно легче, чем у парафинов (наиболее легко замещается водород у α-углеродного атома по отношению к двойной связи благодаря σ,π-сопряжению (сверхсопряжению). При разрыве таких СН-связей образуется радикал, стабилизированный сопряжением (см. главу 2).
В реакциях присоединения двойная связь обычно выступает как донор электронов. Поэтому для олефинов характерны реакции электрофильного присоединения (АЕ).
Гидрирование
Присоединение водорода к алкенам происходит только в присутствии катализаторов, как гетерогенных (Pt, Pd, Ni) так и гомогенных. Наиболее часто проводят каталитическое гидрирование на гетерогенных катализаторах:
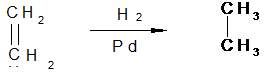
этилен этан
Галогенирование
Олефины легко присоединяют галогены. Скорость реакции зависит от природы галогена и строения алкена. Фтор реагирует с воспламенением, иод – медленно на солнечном свету:
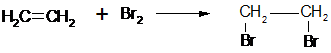
1,2-дибромэтан
Галогены могут присоединяться к олефинам по радикальному или ионному механизму.
При радикальном присоединении атома галогена, присоединение начинается к наиболее доступному из атомов углерода с образованием наиболее стабильного из возможных радикалов:
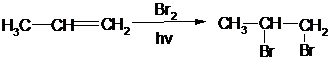
пропен 1,2-дибромпропан
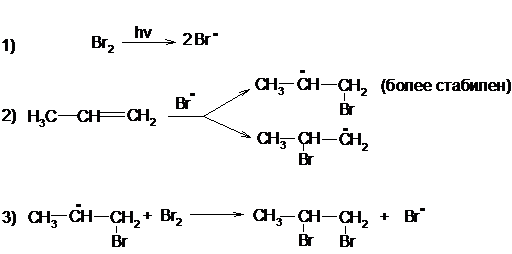
Чаще происходит присоединение по ионному электрофильному механизму. Молекула галогена атакует двойную связь, захватывая электроны и образуя так называемый π-комплекс. Затем отделятся отрицательный ион галогена. К возникшему карбониевому или бромониевому катиону присоединяется отрицательный ион галогена:
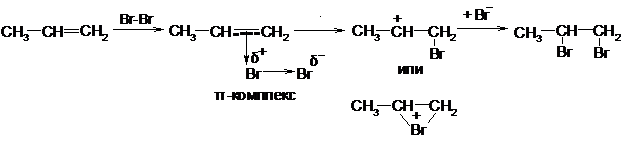
Реакция олефинов с галогенами служит для качественного и количественного определения их в смеси.
