Расчеты по химическому уравнению
Запишем в общем виде уравнение химической реакции:
aA + bB = cC + dD
Для любой пары веществ, вступивших в химическую реакцию или получившихся в результате реакции, отношение количеств веществ равно отношению стехиометрических коэффициентов в уравнении:
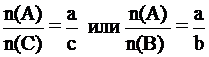
где: 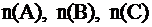 - количества вступивших в реакцию или получившихся в результате реакции веществ А, В, С.
- количества вступивших в реакцию или получившихся в результате реакции веществ А, В, С.
a, b, c - стехиометрические коэффициенты перед формулами этих веществ в уравнении реакции.
Однако в условиях реального проведения химического процесса всегда получается меньшее количество целевого продукта, чем это следует из расчета по химическому уравнению. Это связано с неизбежными потерями реагентов и продуктов реакции, а также обратимостью, а потому и неполнотой прохождения химических реакций. Количественно близость количеств практически полученных продуктов реакции к рассчитанным по стехиометрическим уравнениям характеризуется величиной выхода продукта реакции. В зависимости от характера используемых для вычисления выхода продукта реакции величин различают:
молярную долю выхода продукта реакции (эта):
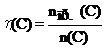 ,
,
где: n(C) – количество вещества (продукта), которое должно быть получено в соответствии с расчетом по стехиометрическому уравнению,
nпр.(C) – количество практически полученного вещества (продукта);
массовую долю выхода продукта реакции (эта):
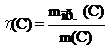 ,
,
где: m(C) – масса вещества (продукта), которая должна быть получена в соответствии с расчетом по стехиометрическому уравнению, mпр.(C) – масса практически полученного вещества (продукта);
объемную долю выхода продукта реакции (эта):
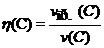
где: v(C) – объем вещества (продукта), который должен быть получен в соответствии с расчетом по стехиометрическому уравнению,
vпр.(C) – объем практически полученного вещества (продукта).
Величина выхода продукта реакции не зависит от того, будет ли она вычислена через массы, объемы или количества веществ.
Химический эквивалент
В тех случаях, когда возникает необходимость в проведении большого объема стехиометрических расчетов (химический анализ) удобно пользоваться понятием «химический эквивалент».
Химическими эквивалентами называют условные частицы вещества в целое число раз меньшие, чем соответствующие им формулъные единицы. В химических реакциях эквиваленты равноценны одному атому или иону водорода или одному электрону.
Расчеты с использованием понятия «химический эквивалент» гораздо проще, поскольку согласно закону эквивалентов В. Рихтера (1793 г.) один эквивалент одного вещества всегда взаимодействует с одним эквивалентом другого.
Отсюда следует, что равны и числа эквивалентов реагирующих веществ: Nэк(А) = Nэк(В), а также кратные им количества вещества эквивалентов: nэк(А) = nэк(В)
В формульной единице вещества может содержаться 1, 2, 3, ..., а в общем случае zB эквивалентов вещества. zB называется фактором эквивалентности.
В обменных реакциях
Фактор эквивалентности для кислоты равен числу атомов водорода, замещенных в формульной единице кислоты в результате реакции. Фактор эквивалентности основания равен числу гидроксид-ионов замещенных в формульной единице основания в результате реакции.
1) 3KOH + H3Р04 = K3Р04 + 3Н2O
zB (H3Р04)= 3 zB(K0H) = 1
2) 2KOH + H3Р04 = K2HР0 4 + Н2O
zB (H3Р04) = 2 zB(K0H) =1
