Молекулярно-кинетические свойства дисперсных систем.
Молекулярно-кинетические свойства дисперсных систем обусловлены хаотическим тепловым движением молекул дисперсионной среды, которое складывается из поступательного, вращательного и колебательного движения молекул. Молекулярно-кинетические свойства проявляются в броуновском движении, диффузии, осмосе и седиментационном равновесии.
Броуновским называют непрерывное, хаотическое, равновероятное для всех направлений движение мелких частиц, взвешенных в жидкости или газе, за счет воздействия молекул дисперсионной среды. Находясь в жидкости или газообразной среде, коллоидные частицы, испытывают удары со стороны молекул среды и совершают сложный путь, многократно изменяя направление своего движения. Броуновское движение характеризуется величиной среднего сдвига частицы 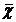 , который представляет собой изменение координат частицы за определенный промежуток времени. Средний сдвиг частицы
, который представляет собой изменение координат частицы за определенный промежуток времени. Средний сдвиг частицы 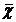 при броуновском движении рассчитывается по формуле:
при броуновском движении рассчитывается по формуле:
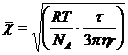 (11),
(11),
где:
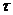 - время,
- время,
r – радиус частиц дисперсной фазы,
NA – число Авогадро, равное 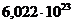 моль-1,
моль-1,
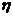 - вязкость дисперсной среды,
- вязкость дисперсной среды,
R – универсальная газовая постоянная,
T – температура в градусах шкалы Кельвина.
Диффузией называют самопроизвольное распространение вещества из области с большей концентрацией в область с меньшей концентрацией. Диффузия непосредственно связана с броуновским движением. Количественно диффузия характеризуется коэффициентом диффузии – D. Коэффициент диффузии сферических коллоидных частиц рассчитывается по уравнению Эйнштейна:
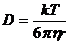 (12),
(12),
где:
k – константа Больцмана, равная 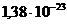
Чем меньше коэффициент диффузии D, тем продолжительнее процесс диффузии. Коэффициент диффузии D связан со средним сдвигом частицы 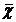 , эта связь описывается уравнением Эйнштейна-Смолуховского:
, эта связь описывается уравнением Эйнштейна-Смолуховского:
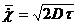 (13),
(13),
где:
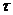 - время диффузии.
- время диффузии.
Осмос. Осмос характерен как для коллоидных, так и для истинных растворов. При разделении двух растворов различной концентрации или раствора и чистого растворителя полупроницаемой перегородкой (мембраной) возникает поток растворителя от меньшей концентрации к большей. Этот процесс называется осмосом. Движущая сила осмоса – выравнивание концентрации. За счет диффузии жидкость из области с более высокой концентрацией самопроизвольно перемещается в область с меньшей концентрацией. Это перемещение обусловлено тем, что число ударов молекул на мембрану со стороны чистого растворителя больше, чем со стороны раствора. Это избыточное число ударов и является причиной перемещения растворителя через поры мембраны туда, где его меньше, то есть в область коллоидного раствора. В результате перемещения жидкости возникает избыточное давление 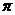 , называемое осмотическим. Осмотическое давление – это такое избыточное давление над раствором, которое необходимо для исключения переноса растворителя через мембрану, то есть для прекращения осмоса. Осмотическое давление коллоидных растворов рассчитывается по формуле:
, называемое осмотическим. Осмотическое давление – это такое избыточное давление над раствором, которое необходимо для исключения переноса растворителя через мембрану, то есть для прекращения осмоса. Осмотическое давление коллоидных растворов рассчитывается по формуле:
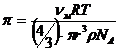 (14),
(14),
где:
νм – массовая концентрация дисперсной фазы,
R – универсальная газовая постоянная,
T – температура в градусах шкалы Кельвина,
r – радиус частиц дисперсной фазы,
ρ – плотность материала частиц,
NA – число Авогадро, равное 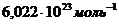
Осмос, как и все молекулярно-кинетические свойства, характерен для высокодисперсных систем, размер частиц дисперсной фазы которых не превышает 0,1 мкм.
