Потенциалы металлических и газовых электродов
eг.э. = jк - ja , где
jк – потенциал положительного электрода (в элементе катод);
ja – потенциал отрицательного электрода (в элементе анод).
Если потенциал одного из электродов принять равным 0, то относительный потенциал второго электрода будет равен ЭДС элемента.
 Таким образом можно определить относительный потенциал любого электрода.
Таким образом можно определить относительный потенциал любого электрода.
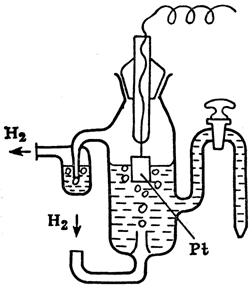
| Рис.16. Водородный электрод |
В настоящее время за 0 принят потенциал стандартного водородного электрода (рис.16.)
Равновесие на водородном электроде:
2H+ + 2℮ = H2.
Для определения потенциалов электродов по водородной шкале собирают гальванический элемент, слева – водородный электрод, справа – измеряемый электрод:
H2, Pt | H+ || Меn+ | Ме
eг.э. = jп - jл .
Т.к. jл = 0 => eг.э.= jп = jМеn+/ Ме.
Используем уравнение (5):
 |
RT
 jМеn+/ Ме = j0Меn+/ Ме + ∙lnaМеn+ —
jМеn+/ Ме = j0Меn+/ Ме + ∙lnaМеn+ —
nF
уравнение Нернста для потенциала металлического электрода.
При Т = 298К, подставляя значения R и F, получаем
 0,059
0,059
 jМеn+/ Ме = j0Меn+/ Ме + ∙lgaМеn+
jМеn+/ Ме = j0Меn+/ Ме + ∙lgaМеn+
n
Для разбавленных растворов a » c.
j0Меn+/ Ме – стандартный потенциал металлического электрода.
Стандартным потенциалом металлического электрода называют потенциал этого электрода в растворе собственных ионов с активностью их, равной 1.
Ряд напряжений металлов:
| Li | Rb | K | Ba | Sr | Ca | Na | Mg | Al | Mn | Zn | Cr | Fe | |
| -3.02 | -2.99 | -2.92 | -2.90 | -2.89 | -2.87 | -2.71 | -2.34 | -1.67 | -1.05 | -0.76 | -0.71 | -0.44 | |
| Cd | Co | Ni | Sn | Pb | H | Sb | Bi | Cu | Hg | Ag | Pd | Pt | Au |
| -0.40 | -0.29 | -0.25 | -0.14 | -0.13 | 0.0 | +0.20 | +0.23 | +0.24 | +0.79 | +0.80 | +0.83 | +1.20 | +1.42 |
Водородный электрод: H2, Pt | H+
2H+ + 2℮ = H2. 0,059 a2H+

 При Т = 298К уравнение Нернста: j2H+/H2 = ∙ lg
При Т = 298К уравнение Нернста: j2H+/H2 = ∙ lg
2 PH2
Учитывая, что lg aH+ = -pH => j2H+/H2 = -0.0295∙lg PH2 – 0.059pH.
Если PH2 = 1,
 |
j2H+/H2 = -0,059PH
Кислородный электрод:O2, Pt | OH-
O2 + 2H2O +4℮ = 4OH-
При Т=298К уравнение Нернста:
0,059 PO2 ∙a2H2O

 jО2/ОH- = jоО2/ОH- + ∙ lg
jО2/ОH- = jоО2/ОH- + ∙ lg
4 а4ОН-
0,059
 Т.к. aH2О = const, то значение ∙lg a2H2O
Т.к. aH2О = const, то значение ∙lg a2H2O
введем в joO2/OH-:
PO2
 jO2/OH- = joO2/OH- + 0,0147∙ lg , где
jO2/OH- = joO2/OH- + 0,0147∙ lg , где
a4OH-
jоО2/ОH- - стандартный потенциал кислородного электрода, равный 0,401 В.
KH2O
 Учитывая аOH- = и lg aH+ = -PH, получаем
Учитывая аOH- = и lg aH+ = -PH, получаем
aH+
jО2/ОH- = 1,23 + 0,0147∙lgPO2 – 0,059PH
 |
Если PO2 = 1, то jО2/ОH- = 1,23 – 0,059РН (рис.17).
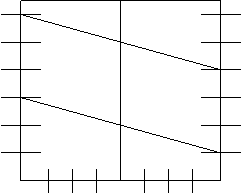
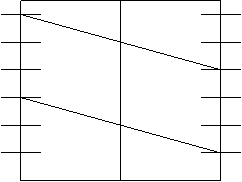 +1,2 +1,2
+1,2 +1,2
+0,8 +0,8
+0,4 +0,4
0 0
 -0,4 -0,4
-0,4 -0,4
-0,8 7 - 0,8
2 4 6 8 10 12 РН
Рис.17. Зависимость потенциалов водородного и кислородного электродов от РН среды при РН2 = 1 и РО2=1 (101 кПа)
ЭЛЕКТРОЛИЗ
Электролизом называют процессы, происходящие на электродах под действием электрического тока, подаваемого от внешнего источника.
При электролизе происходит превращение электрической энергии в химическую.
Ячейка для электролиза, называемая электролизер, состоит из двух электродов и электролита.
Электрод, на котором идет реакция восстановления (катод), у электролизера подключен к отрицательному полюсу внешнего источника тока.
Электрод, на котором протекает реакция окисления (анод), подключен к положительному полюсу источника тока.
Электролиз расплава NaCl:

 NaCl ® Na+ + Cl-
NaCl ® Na+ + Cl-
к катоду к аноду
(-) Катод (восстановление): Na+ + ℮ ® Na0
 (+) Анод (окисление): Cl- - ℮ ® ½Cl02
(+) Анод (окисление): Cl- - ℮ ® ½Cl02
NaCl ® Na0 + ½Cl2
Электролиз водных растворов:
На катоде будут восстанавливаться окисленные формы электрохимических систем, имеющих наибольший электродный потенциал, а на аноде будут окисляться восстановленные формы систем с наименьшим электродным потенциалом.
Катодные процессы:
Необходимо учитывать величину электродного потенциала процесса восстановления ионов водорода: j = -0,059∙РН.
В случае нейтральных растворов (РН = 7):
j = -0,059∙7 = -0,41В.
Поэтому:
1) при электролизе растворов солей, содержащих катионы металла, электродный потенциал которого значительно положительнее, чем -0,41В, из нейтрального раствора такого электролита на катоде будет восстанавливаться металл. Такие металлы находятся в ряду напряжений вблизи водорода (начиная приблизительно от олова и после него);
2) при электролизе растворов солей, содержащих катионы металла, электродный потенциал которого значительно более отрицательный, чем -0,41В, металл восстанавливаться на катоде не будет, а произойдет выделение водорода. К таким металлам относятся щелочные, щелочноземельные, магний, алюминий, приблизительно до титана;
3) при электролизе растворов солей, содержащих катионы металла, электродный потенциал которого близок к величине -0,41В (металлы средней части ряда – Zn, Cu, Fe, Cd, Ni), в зависимости от концентрации раствора соли и условий электролиза (плотность тока, температура, состав раствора), возможно как восстановление металла, так и выделение водорода; иногда наблюдается совместное выделение металла и водорода.
В кислых растворах: 2Н+ +2℮ ® H2
В нейтральных или щелочных растворах: 2Н2О + 2℮ ® H2 + 2OH-
Анодные процессы:
Характер реакций, протекающих на аноде, зависит как от присутствия молекул воды, так и от вещества, из которого сделан анод.
Материал анода в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным (нерастворимым) анодом и электролиз с активным (растворимым) анодом.
Нерастворимые аноды изготавливаются из угля, графита, платины, иридия.
Растворимые аноды изготавливаются из меди, серебра, цинка, кадмия, никеля и других металлов.
1) На инертном аноде при электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, а также фтороводорода и фторидов происходит электрохимическое окисление воды с выделением кислорода.
В щелочной среде: 4ОН- = О2 + 2Н2О + 4℮.
В кислой и нейтральной среде: 2Н2О = О2 + 4Н+ + 4℮.
Пример: 2SO2-4 = S2O2-8 + 2℮ jo = +2,01В
2H2O = O2 + 4H+ + 4℮ jo = +1,23В
2) При электролизе водных растворов бескислородных кислот и солей (кроме HF и фторидов) у анода разряжаются анионы. При электролизе растворов HI, HBr, HCl и их солей у анода выделяется соответствующий галоген.
Примеры
I. Электролиз с нерастворимым анодом водного раствора Na2SO4:
Na2SO4 ® 2Na+ + SO2-4
H2O = H+ + OH-
При РН = 7 j2H+/H2 = -0,41В.
Т.к. joNa+/Na = -2,71в << j2H+/H2, то на катоде будет выделяться водород.
На аноде будет выделяться кислород.
(-) Катод (восстановление): 2Н2О + 2℮ ®H2 + 2OH-
(+) Анод (окисление): Н2О – 2℮ ® ½O2 + 2H+
В растворе 2Н+ + 2ОН- = 2Н2О
Суммарная реакция: H2O = H2 + ½O2 (разложение воды).
II. Электролиз раствора NaCl:
NaCl ® Na+ + Cl-
H2O = H+ + OH-
joNa+/Na = -2,71В joCl2/2Cl- = +1,356В
j2H+/H2(PH=7) = -0,41В jO2/OH- = 1,23 – 0,059РН = +0,817В
(-) Катод (восстановление): 2H2O + 2℮ ® H2 + 2OH-
(+) Анод (окисление): 2Cl- - 2℮ ® Cl2
Выделение хлора противоречит взаимному положению систем в ряду стандартных электродных потенциалов. Эта аномалия связана со значительным перенапряжением второго из этих процессов - материал анода оказывает тормозящее действие на процесс выделения кислорода.
2H+ + 2OH- + 2Na+ + 2Cl- ® H2 + 2Na+ + 2OH- +Cl2
Кроме Н2, Cl2, в результате реакций получают щелочь.
III. Электролиз раствора NiSO4 c никелевым анодом:
NiSO4 ® Ni2+ + SO2+4
H2O = H+ + OH-
joNi2+/Ni = -0,25В jO2/OH-(PH=7) = 1,23 – 0,059РН = +0,817В
j2H+/H2(PH=7) = -0,41В joSO42+4/S2O82- = +2,01В
joNi2+/Ni = -0,25в
(-) Катод (восстановление): Ni2+ + 2℮ ® Nio
(+) Анод (окисление): Ni0 – 2℮ ® Ni2+
Электролиз сводится к растворению металла анода и выделению его на катоде.
КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
Коррозия– это разрушение металлов в результате его физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты коррозии, состав которых зависит от условий коррозии.
По механизму протекания коррозийного процесса, зависящему от характера внешней среды, с которой взаимодействует металл, различают:
1) биохимическую коррозию;
2) химическую коррозию;
3) электрохимическую;
4) электрокоррозию.
Химическая коррозия характерна для сред не проводящих электрический ток.
При химической коррозии происходит прямое гетерогенное взаимодействие металла с окислителем окружающей среды. По условиям протекания коррозийного процесса различают:
а) газовую коррозию - в газах и парах без конденсации влаги на поверхности металла, обычно при высоких t (окисление металла кислородом воздуха при высоких t);
б) коррозию в неэлектролитах – агрессивных органических жидкостях, таких, как сернистая нефть.
Электрохимическая коррозияхарактерна для сред, имеющих ионную проводимость. При электрохимической коррозии процесс взаимодействия металла с окислителем включает анодное растворение металла и катодное восстановление окислителя.
Электрохимическая коррозия может протекать:
а) в электролитах;
б) в атмосфере любого влажного газа;
в) в почве.
Пример:медная заклепка на железном листе во влажно-воздушной среде.
 Fe2+ Fe2+
Fe2+ Fe2+


 Fe ( Cu ) Fe
Fe ( Cu ) Fe
Металлы находятся в контакте между собой, следовательно, в воде эта система представляет собой гальванический элемент, во внутренней цепи которого Fe является анодом (jo = -0,44В), а медь катодом (jo = +0,34В):
(-) Анод (окисление): Feo – 2℮ ® Fe2+
(+) Катод (восстановление): O2 +2H2O +4℮ = 4OH-
Fe2+ + 2OH- = Fe (OH)2
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 – ржавчина.
