Волгодонский инженерно-технический институт – филиал НИЯУ МИФИ
Волгодонский инженерно-технический институт – филиал НИЯУ МИФИ
Методические указания для выполнения лабораторных работ
По химии
Е.И.Шаврак
Волгодонск 2014
Содержание
| Общие правила работы в лаборатории | |
| Правила оформления отчета о лабораторных работах | |
| Лабораторная работа 1. Определение эквивалентной массы металла по объему вытесненного водорода. | |
| Лабораторная работа 2. Зависимость свойств элементов от положения в периодической системе Д.И.Менделеева | |
| Лабораторная работа 3. Классы соединений и химическая связь | |
| Лабораторная работа 4. Определение теплового эффекта химического процесса | |
| Лабораторная работа 5. Скорость химических реакций и химическое равновесие | |
| Лабораторная работа 6. Водородный показатель среды. Гидролиз солей | |
| Лабораторная работа 7.Жесткость воды и способы ее устранения | |
| Лабораторная работа 8.Окислительно-восстановительные реакции | |
| Лабораторная работа 9.Органические вещества |
ОБЩИЕ ПРАВИЛА РАБОТЫ В ЛАБОРАТОРИИ
Каждый студент, работающий в химической лаборатории, должен строго соблюдать следующие правила работы:
1. Перед каждой лабораторной работой изучить относящийся к ней теоретический материал.
2. Проводить опыты только после внимательного прочтения полного описания работы и уяснения техники её выполнения.
3. Приступать к работам в химической лаборатории только после изучения правил по технике безопасности, получения инструктажа от преподавателя и росписи в журнале по технике безопасности.
4. Все лабораторные работы выполнять индивидуально или группами по 2-3 человека.
5. Не расходовать реактивов больше требуемого количества, это даёт экономию реактивов и времени.
6. Неизрасходованные или взятые в избытке реактивы нельзя выливать в склянки, их надо сдавать лаборанту.
7. Не загромождать рабочее место. Запрещается класть на стол портфели, книги, свёртки, тубусы и т.п.
8. Не уносить приборы, аппараты, реактивы общего пользования на своё рабочее место. Принять за правило: каждый предмет или реактив ставить на своё место немедленно после использования.
9. Концентрированные кислоты, щёлочи, отработанную хромовую смесь ни в коем случае не выливать в раковину, а выливать их в специально отведённые стеклянные банки под тягой. Бумагу и отходы твёрдых веществ, бросать в урны или в банки.
10. Все работы с вредными веществами проводить только под тягой. Под тягой наливать концентрированные кислоты и щёлочи и не выносить их на рабочее место.
11. Не путать пробки от склянок и пипетки для взятия реактивов.
12. Соблюдать в лаборатории тишину. Во время работы не разговаривать с соседом.
13. Горячие приборы и сосуды ставить только на специальные подставки, а не прямо на стол.
14. По окончании работ вымыть химическую посуду, тщательно убрать рабочее место, выключить воду, электричество и газ.
15. Всегда вести запись проведённых работ. Пока выполненный опыт не записан, не переходить к следующему.
ЛАБОРАТОРНАЯ РАБОТА №1
ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТА (ЭКВИВАЛЕНТНОЙ МАССЫ) МЕТАЛЛА ПО ОБЪЁМУ ВЫТЕСНЕННОГО ВОДОРОДА
Ц е л ь р а б о т ы: Ознакомиться с методикой определения и расчёта молярной массы эквивалента металлов.
О б о р у д о в а н и е и м а т е р и а л ы: штатив, две бюретки на 50 см3, пробирка с газоотводной трубкой, термометр, барометр, аналитические весы и разновесы; навеска металла около 0,01 г; 2,5 М раствор НС1.
Методика выполнения работы
По объёму вытесненного водорода можно определить молярные массы эквивалентов активных металлов (магния, алюминия, цинка и т.д.), способных вытеснять водород из разбавленных кислот.
Прибор для определения молярной массы эквивалента металлов изображён на рис. 1.1. и состоит из:
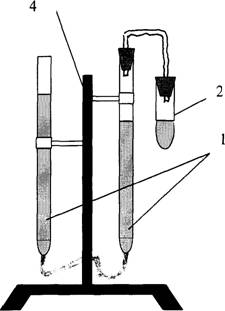 |
1) двух бюреток на 50 см3, соединённых резиновой трубкой;
2) реакционной пробирки;
3) газоотводной трубки;
4) штатива.
Налить в пробирку 4-5 см3 2,5 М раствора хлористоводородной кислоты, 5 капель раствора Со(NO3)2 – катализатора. Навеску металла количественно перенести в пробирку c кислотой, которую плотно присоединить к прибору. Тотчас начинается выделение водорода и вода вытесняется из правой бюретки в левую. Пока идёт реакция, записать показания барометра и термометра; по табл. 1 определить давление насыщенных паров воды.Когда весь металл растворится, прекратится понижение уровня воды в бюретке. Окончательный точный отсчёт показаний бюретки производится после охлаждения пробирки до комнатной температуры (через 3-5мин.).
Результаты измерений записывают по форме:
Масса металла, m=..., г
Показания бюретки до проведения реакции V1=..., см3
Показания бюретки после реакции V2=..., см3
Объём выделившегося водорода VH2 =V2 – V1=..., см3
Температура окружающей среды t=..., ° С; Т=273 +t= ..., К
Атмосферное давление Р=..., Па
Давление насыщенных паров воды 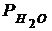 = ..., Па
= ..., Па
Парциальное давление водорода 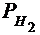 =
=  -
- 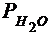 = ..., Па
= ..., Па
Объём выделившегося водорода приводят к нормальным условиям на основании уравнения состояния идеального газа, объединяющего законы Бойля-Мариотта и Гей-Люссака:
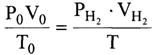
где P0 - нормальное давление, равное 101325 Па; Vo - объём газа при нормальных условиях, см3; То - 273 К; 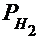 - парциальное давление сухого водорода;
- парциальное давление сухого водорода; 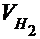 - объём газа в условиях опыта; Т - температура опыта по абсолютной шкале температур.
- объём газа в условиях опыта; Т - температура опыта по абсолютной шкале температур.
Таким образом, объём водорода, приведённый к нормальным условиям, определяется по уравнению:
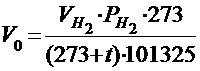 ;
;
По закону эквивалентов в случае, когда одно из реагирующих веществ находится в твёрдом состоянии, а второе - в газообразном, молярная масса эквивалента металла определяется по формуле:
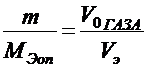
где m - масса металла; МЭоп - молярная масса эквивалента металла; Vo -объём газа, приведённый к нормальным условиям; Vэ - молярный объём эквивалента газа.Молярный объём эквивалента водорода, составляющий 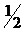 объёма его моля, занимает при нормальных условиях 11200 см3/моль.
объёма его моля, занимает при нормальных условиях 11200 см3/моль.
Таблица 1.
Давление насыщенного водяного пара в равновесии с водой

Затем студенты вычисляют теоретическую величину молярной массы эквивалента металла и находят относительную ошибку определения:
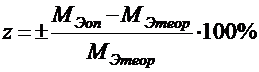
В конце работы записываются выводы.
Контрольные вопросы.
1. Что называется молярной массой эквивалента элемента? В каких единицах измеряется молярная масса эквивалента?
2.. Сформулируйте закон эквивалентов. Выразите его математически.
3. Какие факторы оказывают влияние на точность определения молярной массы эквивалента металла при взаимодействии его с кислотой?
ЛАБОРАТОРНАЯ РАБОТА №2
Методика выполнения работы
Опыт №1. Взаимодействие щелочных металлов с водой.
Налить в фарфоровую чашку немного воды, опустить в неё кусочек натрия и быстро прикрыть чашку часовым стеклом или воронкой. (Осторожно! Брызги щёлочи могут попасть на открытые участки кожи человека и одежды). После окончания реакции прилить к полученному раствору 2-3 капли фенолфталеина. Написать уравнение протекающей реакции.
Опыт №2. Действие воды на металлический магний.
Поместить в пробирку стружку металлического магния, добавить немного воды и 2-3 капли раствора фенолфталеина. Обратить внимание, что цвет раствора практически не изменяется. Затем следует нагреть пробирку. Отметить изменение окраски раствора. Сделать выводы относительно щелочных свойств гидроксида магния и написать уравнение протекающей реакции.
Опыт №3. Амфотерность металлического алюминия.
Поместить кусочек металлического алюминия в пробирку, прилить немного воды и 2-3 капли фенолфталеина. Убедиться в том, что ни в обычных условиях, ни при нагревании алюминий с водой практически не взаимодействуют. Затем поместить в две другие пробирки по кусочку алюминия. В одну из них прилить разбавленную соляную кислоту, в другую -раствор крепкой щёлочи NaOH. Пробирки нагреть. При этом наблюдается взаимодействие алюминия как с кислотами, так и со щелочами. Написать уравнения протекающих реакций и сделать выводы о свойствах алюминия.
Опыт № 4. Неметаллические свойства элементарной серы.
Кусочек элементарной серы поместить в пробирку и налить немного воды. Прибавить сначала 2-3 капли фенолфталеина, а затем - столько же метилоранжа. Отметить, что сера не взаимодействует с водой в обычных условиях. Нагреть пробирку. Обратить внимание, что и после нагревания взаимодействие серы с водой не происходит.
Кусочек серы положить на железную ложечку, поджечь и опустить в коническую колбу, в которую было налито немного воды (ложечкой с горящей серой поверхности воды не касаться). После сгорания серы закрыть колбу пробкой и встряхнуть. Полученный раствор разделить на три пробирки и испытать различными индикаторами. Написать уравнения химических реакций.
Контрольные вопросы
1. Что такое энергия ионизации и сродство к электрону, и как эти величины изменяются в периодах и группах периодической системы Д.И. Менделеева?
2. Чем объяснить наличие металлических свойств у одних элементов и неметаллических - у других?
3. Какие элементы называются амфотерными, почему?
ЛАБОРАТОРНАЯ РАБОТА №3
Методика выполнения работы
Опыт № 1. Кислотные свойства водного раствора СO2.
Отводную трубку аппарата Киппа, в котором происходит образование СO2, опустить в пробирку с известковым молоком, предварительно испытав его с помощью фенолфталеина. Пропустить газ в известковое молоко до образования белого осадка и обесцвечивание окраски реакционной смеси. Составить уравнения реакции, сделать вывод относительно свойств водного раствора СО2. Составить структурную формулу углекислого газа, определить тип связи.
Опыт № 2. Амфотерные свойства гидроксида хрома (III).
Поместить в пробирку 8-10 капель раствора сульфата хрома (III) и добавить несколько капель раствора щелочи до полного выпадения осадка гидроксида хрома. Составить структурную формулу этого соединения, определить тип связи.
Распределить содержимое на две пробирки и добиться растворения осадка в каждой из них с помощью: в одном случае 2 М раствора НС1, в другом - 2 М раствора NaOH. Составить уравнения реакций, зная, что при реакции гидроксида хрома с NaOH образуется гексагидроксохромит натрия
Na3 [Cr(OH)6].
Контрольные вопросы
1.Как меняются свойства оксидов, гидроксидов, а также характер химической связи и тип кристаллической решетки в периоде и группе?
2. Как изменяются свойства оксидов и гидроксидов одного и того же элемента с увеличением его степени окисления?
3. Приведите современную формулировку периодического закона.
ЛАБОРАТОРНАЯ РАБОТА №4
Методика выполнения работы
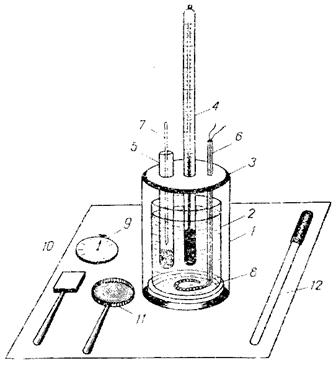
Определение тепловых эффектов химических процессов проводят с помощью калориметрической установки (рис.2). Она состоит из наружного стакана 1 емкостью 500 мл и внутреннего (собственно калориметра) емкостью 350 мл 2, установленного на эбонитовой подставке. Калориметр закрывается эбонитовой крышкой 3, имеющей три отверстия: для термометра 4, пробирки 5, в которой помещается вещество, предназначенное для растворения, и для мешалки 6. Мешалка изготовлена из стеклянной трубки, внутрь которой вмонтирован электрический нагреватель 8. В пробирку с растворяемым веществом помещается стеклянная палочка с острым концом 7, служащая для разбивания дна пробирки. Под номерами 9-12 указаны принадлежности, выполняющие вспомогательные функции при определении тепловых эффектов.
Опыт №1. Определение знака теплового эффекта процесса растворения соли в воде.
В калориметрический стакан почти до дна опустить укрепленный в штативе термометр. Загрузить 30 г кристаллического нитрата аммония в стакан так, чтобы шарик термометра был закрыт. Затем в стакан влить 50 см3 воды и поместить в него пробирку, на четверть заполненную водой. Осторожно помешать стеклянной палочкой. Определить знак теплового эффекта процесса растворения нитрата аммония в воде, основываясь на том факте, что вода в пробирке замерзает. Для этого опыта можно брать и другие вещества (NН4Cl, КNО3).
Опыт №2. Установление количественного значения теплового эффекта процесса растворения соли.
Взвесить на технохимических весах бюкс с крышкой. Затем поместить навеску (2-4 г ) безводной соли СuSО4 в бюкс, накрыть его крышкой и снова произвести взвешивание. Быстро перенести навеску в калориметрический стакан. Отмерить цилиндром 50 см3 дистиллированной воды, замерить ее температуру Т1. Часть воды перелить в стакан, а оставшейся водой тщательно обмыть бюкс , и остатки слить в калориметрический стакан. Быстро помешивая, замерить максимальную температуру раствора Т2 с точностью до 0,1 ºС.
Результаты свести в таблицу 3.2.
| Масса бюкса, г | Масса бюкса с СuSО4, г | Навеска СuSО4, г | Vводы, см3 | Т1 (до реакции), К | Т2 (после реакции), К | ΔТ, К | ΔНоп (опыт ное) | ΔНт (теоре ти ческое) |
Расчеттеплового эффекта:
1.Рассчитать, сколько теплоты (ΔН) выделяется при растворении взятой навески СuSО4
ΔН = (mж ·Сж + mст ·Сст) · ΔТ , (Дж),
где mж и mст - масса жидкости в стакане и масса самого стакана, кг; Сж и Сст – удельные теплоемкости стекла и жидкости (Сст = 0,75·103 Дж/кг· К, Своды = 4,18·103 Дж/кг· К), mж = Vводы·ρ (ρ=1г/см3)
2. Рассчитать тепловой эффект реакции нейтрализации (ΔНоп):
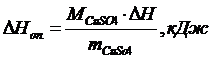 ,
,
где М СuSО4 - молярная масса соли.
– молярная масса соляной кислоты.
3. Определить относительную ошибку опыта. Гидратация безводной соли и растворение пятиводной соли (кристаллогидрата в воде) выражается уравнениями:
СuSО4 + 5 Н2О = СuSО4 · 5 Н2О, ΔН = -74,4 кДж
СuSО4 · 5 Н2О + аq = СuSО4 · аq, ΔН = +11,0 кДж
ΔНт (СuSО4 · 5 Н2О) = -63,4 кДж
Контрольные вопросы
1. Что называется стандартной энтальпией образования соединения? Какие условия принято называть стандартными?
2. Какие химические реакции называются экзотермическими, эндотермическими?
7. Стандартные энтальпии образования ΔН0298(кДж/моль) ΝН3 и РН3 равны соответственно – 46,2 и + 5,4. Какой следует сделать вывод из этих данных об относительной устойчивости молекул ΝН3 и РН3?
ЛАБОРАТОРНАЯ РАБОТА №5
Методика выполнения работы
Опыт №1. Зависимость скорости реакции от концентрации реагирующих веществ.
Зависимость скорости реакции от концентрации в гомогенной системе изучим на примере реакции:
2KIOз+5Na2SOз+H2S04=K2S0 4+5Na2S0 4+I 2+H 2О
При взаимодействии йода калия с сульфатом натрия в кислой среде образуется элементарный йод, который можно обнаружить с помощью крахмала.
Для выполнения опыта взять три пробирки, налить в них из бюретки раствор йодата калия (3,9 г. соли на 100 см3 воды): в первую пробирку 6 см3 КIOз, во вторую - 4см КIOз и 2 см3 Н2О, в третью - 2 см КIOз и 4 см3 H2O. Затем из другой бюретки с раствором сульфита натрия, подкислённого серной кислотой и содержащего немного крахмала (сульфит натрия 1г.; 0,94 см3 концентрированной серной кислоты и 0,1 г. крахмала на литр смеси), отмерить 6 см3 смеси в чистый стаканчик. Вылить содержимое стаканчика в первую пробирку и одновременно включить секундомер. Отметить время, в течение которого появляется синее окрашивание после приливания сульфита натрия. Аналогично поступить и с другими растворами йодата калия. Результаты занести в таблицу.
Таблица
| № пробирки | V,см3 КlOз | V,см3 Н20 | V cуммарный см3 | Концентра ция С | Время окрашива- ния τ, с | Относи- тельная скорость ν =1/ τ, с-1 |
Приняв концентрацию раствора йодата калия, к которому не добавляли воду, за единицу, вычислить концентрации в двух других случаях. Построить график зависимости скорости реакции от концентрации иодата калия
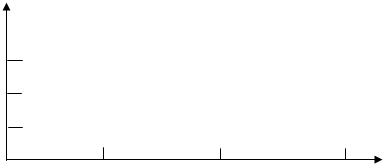 |
v=1/τ, c-1
С
Опыт № 2. Зависимость скорости реакции от температуры.
Зависимость скорости реакции от температуры в гомогенной среде изучают на примере реакции:
Na2S2Оз+H2SО4=Na2SО4+SО2+S+H2О
При взаимодействии раствора тиосульфата натрия с серной кислотой выпадает в осадок сера, вызывающая при достижении определённой концентрации помутнение раствора. По промежутку времени от начала реакции до заметного помутнения раствора можно судить об относительной скорости этой реакции.
Налить в одну пробирку 5см3 раствора тиосульфата натрия (0,3 М), в другую - 5 см3 раствора серной кислоты (0,3 М). Обе пробирки поместить в стакан с водой на 5-7 мин с тем, чтобы растворы приняли температуру воды, и записать ее в журнал. Слить вместе содержимое обеих пробирок. Точно отметить время от начала реакции до появления помутнения. В две другие пробирки налить по 5 см3 тех же растворов. Поместить пробирки в водяную баню или стакан с водой, нагреть воду на 10°С выше температуры предыдущего опыта. Выдержать пробирки при этой температуре 5-7 мин; слить содержимое пробирок. Измерить время до появления мути. Повторить опыт, повысив температуру ещё на 10°С. Результаты опытов свести в таблицу
Таблица
| № опыта | Температура опыта Т, К | Время появления помутнения τ, с | Относительная скорость реакции ν yсл.=1/ τ, c-1 |
По полученным данным построить график зависимости модуля логарифма скорости реакции от обратной величины абсолютной температуры в координатах, представленных на рис. 6.2.

рис.6.2
Сделать вывод о зависимости скорости реакции от температуры. Из графика определяют тангенс угла наклона α и вычисляют энергию активации:
Е = 2,303R • tgα, Дж/моль
Экстраполировав полученную прямую до пересечения с осью lgυ, найти отрезок, равный десятичному логарифму предэкспоненциального множителя в уравнении Аррениуса. Далее рассчитать значения констант скорости реакций для каждой температуры и на их основании – среднее значение температурного коэффициента скорости реакции.
Опыт №3. Влияние концентрации реагирующих веществ на смещение химического равновесия.
Смещение химического равновесия вследствие изменения концентрации реагирующих веществ исследуется на примере реакции:
FeCl3+3NH4CNS↔3NH4Cl+Fe(CNS)3
Отмерить мерной пробиркой по 5 cм3 paзбaвлeнныx растворов хлорида железа (III) и роданида аммония (0,003 М FeCI 3 и 0,01 М NH4CNS), смешать их и разделить поровну на 4 пробирки. Окраску раствору придаёт образующийся роданид железа. Одну пробирку оставить для сравнения, во вторую - добавить 3-4 капли концентрированного раствора FеС13, в третью - 3-4 капли насыщенного раствора NH4CNS, а в четвёртую - насыпать немного кристаллического хлорида аммония.
Сравнить окраску растворов в трёх пробирках с окраской в контрольной пробирке. По изменению интенсивности окраски определить направление смещения равновесия и объяснить происходящие явления, исходя из принципа Ле Шателье.
Контрольные вопросы.
1. Дайте определение скорости химической реакции, в каких единицах выражается её величина?
2. Сформулируйте закон действия масс.
3. Какие факторы влияют на смещение химического равновесия?
ЛАБОРАТОРНАЯ РАБОТА № 7
Методика выполнения работы
Опыт №1. Смещение ионного равновесия в растворах вследствие гидролиза.
В разные пробирки внести небольшое количество следующих соединений: НС1; NaOH; NaCI; Nа2СО3; ZnCl2; Сu(СН3СОО)2. Во все пробирки прилить одинаковое количество воды. Осторожным встряхиванием добиться полного растворения каждой соли. Измерить рН каждого раствора с помощью универсальной индикаторной бумажки и уточнить на иономере И-130 (согласно инструкции по работе на приборе). Для сравнения те же измерения провести с дистиллированной водой. Данные опыта свести в таблицу. Составить молекулярные и ионные уравнения гидролиза солей. Дать объяснение изменению водородного показателя рН в растворах солей в сравнении с его значением в дистиллированной воде.
Таблица
| Формула соединения | Сила электролитов, образующих данную соль | Цвет индикаторной бумажки | Показания иономера, рH | Реакция среды | |
| основание | кислота | ||||
Опыт №2. Усиление гидролиза одной соли раствором другой гидролизующейся соли.
К 3 cм3 концентрированного раствора FеС1з (соль образована слабым основанием и сильной кислотой, её гидролиз протекает в основном только по 1-ой ступени) прилить немного концентрированного раствора Nа2СО3 (соль образована, напротив, сильным основанием и слабой кислотой, её гидролиз протекает также по 1-ой ступени) до образования устойчивого осадка. При этом наблюдается выделение пузырьков газа. В результате сливания двух вышеуказанных растворов происходит образование соли, полученной из слабых основания и кислоты. Эта соль подвергается полному гидролизу. Написать молекулярные и ионные уравнения реакций.
Опыт №3. Растворение металлов в продуктах гидролиза солей.
В первую пробирку налить 3-4 мл концентрированного раствора ZnCl2 и опустить в неё кусочек цинка. В другую пробирку налить столько же концентрированного раствора Na2CO3 и опустить в этот раствор кусочек алюминия. Нагревая пробирки, наблюдать за растворением металлов и выделением газа в обоих случаях. Составить уравнения реакций и объяснить наблюдаемые явления.
Контрольные вопросы
1. К чему сводится суть реакций гидролиза?
3. Какие факторы влияют на степень гидролиза солей?
4. Чем объяснить растворение металлов в растворах некоторых солей?
ЛАБОРАТОРНАЯ РАБОТА № 14
Методика выполнения
Опыт №1. Определение общей жёсткости.
Общую жёсткость определяют титрованием пробы воды раствором трилона Б в присутствии индикатора – эриохром чёрного Т. Наиболее точный результат получается при рН=8-11, поэтому для создания такой среды прибавляют в пробирку аммиачно-буферную смесь (NH4ОH+NH4C1).
Для этого взять 50 см3 воды, прибавить 5 см3 буферной смеси, 5-6 капель индикатора и титровать раствором трилона Б известной концентрации до перехода окраски из розово-красной в зеленовато-синюю.
Расчёт общей жёсткости ведут по формуле:
Жобщ.= 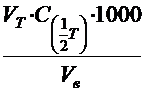 , ммоль/дм3
, ммоль/дм3
где VT - объём раствора трилона Б, пошедший на титрование пробы, см3 ;
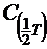 -молярная концентрация эквивалента раствора трилона Б, моль/дм3;
-молярная концентрация эквивалента раствора трилона Б, моль/дм3;
VВ - объём пробы воды, см3.
Опыт №2. Уменьшение жёсткости с помощью катионитной обработки воды.
Пробу воды, для которой определена временная и постоянная жёсткости, пропустить через колонку с катионитом КУ-1 4-5 раз. После катионитной обработки воды определить её временную и постоянную жёсткости. Делают вывод относительно эффективности этого процесса.
Контрольные вопросы
1. Что понимают под термином «жёсткость воды»? В каких единицах измеряется жёсткость?
2. Указать методы умягчения и обессоливания воды.
3. Какими методами можно определить временную и постоянную жёсткости; какие реакции лежат в основе этих методов?
ЛАБОРАТОРНАЯ РАБОТА № 8
Методика выполнения работы
Опыт №1. Окислительные свойства пероксида водорода.
В пробирку налить 1-2 см3 раствора KI, подкислить 2-3 каплями разбавленного раствора H2SО4 и прибавить 1-2 см3 Н 2О2. Наблюдать выделение йода (прибавить 1 каплю раствора крахмала). Какое вещество в этой реакции является окислителем и какое восстановителем? Составить уравнение реакции на основе электронно-ионного баланса.
Опыт №2. Восстановительные свойства пероксида водорода.
В пробирку налить 1-2 см3 раствора КМnO4, подкислить 2-3 каплями разбавленного раствора H2SO4 и прибавить 1-2 см3 раствора Н2O2 до обесцвечивания раствора перманганата. Определить окислитель и восстановитель в этой реакции. Составить уравнение реакции, учитывая, что одним из продуктов является кислород.
Опыт № 3. Влияние характера среды на протекание окислительно-восстановительных реакций.
В три пробирки налить по 1-2 мл раствора КМnO4, затем прибавить: в первую - 5 капель разбавленной серной кислоты, во вторую - 5 капель дистиллированной воды, в третью - 5 капель концентрированного раствора щёлочи. После этого в каждую из пробирок прибавить шпателем одинаковое количество сухой соли Na2SO3. Встряхиванием раствора добиться изменения окраски в каждой из пробирок. Составить уравнение реакций на основе электронного баланса, имея ввиду следующее:
а) во всех трёх случаях ион 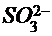 переходит в ион
переходит в ион 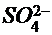 , причём оба иона являются бесцветными и на окраску раствора не влияют;
, причём оба иона являются бесцветными и на окраску раствора не влияют;
б) в кислой среде ион МnО-4 переходит в ион Мn2+
в) в нейтральной среде ион МnО 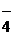 восстанавливается до МnО2;
восстанавливается до МnО2;
г) в щелочной среде образуется ион 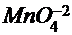 , который окрашивает раствор в зелёный цвет.
, который окрашивает раствор в зелёный цвет.
Опыт № 4. Влияние кислотности среды на направление реакции взаимодействия йода с щёлочью.
Кристаллик йода обработать в пробирке небольшим количеством раствора щёлочи при слабом нагревании. Наблюдать переход йода в раствор. Составить уравнение реакции, имея в виду, что одним из продуктов реакции является йодат щелочного металла.
Полученный раствор подкислить разбавленной серной кислотой. Наблюдать выделение свободного иода. Составить уравнения реакции взаимодействия иодида и иодата в присутствии. Н2SO4. Объяснить, почему реакция пошла в обратном направлении.
Контрольные вопросы
1. Чем объяснить двойственность свойств пероксида водорода в окислительно-восстановительных реакциях?
2. В какой среде КМnO4 является более сильным окислителем?
3. Какой фундаментальный закон природы лежит в основе составления уравнений окислительно-восстановительных реакций методом электронно- ионного баланса?
ЛАБОРАТОРНАЯ РАБОТА № 15
ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
Ц е л ь р а б о т ы: получить и исследовать важнейшие свойства некоторых органических соединений.
О б о р у д о в а н и е и м а т е р и а л ы: штатив с пробирками, нагревательный прибор; ацетат натрия, этанол, формальдегид, ацетон, растворы КМnO4, К2Сг2O7, H2SO4, NaOH, NH4OH, аммиачный раствор оксида серебра.
Методика выполнения
Опыт №1. Получение и свойства предельных углеводородов на примере метана.
Поместить в пробирку тщательно измельчённую смесь, состоящую из ацетата натрия и гидроксида натрия в массовом соотношении 1:2. Пробирку закрыть пробкой с отводной трубкой и нагреть. Происходит образование метана и карбоната натрия. Пропустив полученный метан через водные растворы KMnO4, сделать выводы относительно свойств предельных углеводородов. Написать уравнение реакции получения метана.
Опыт №2. Окисление спиртов.
В пробирку налить 2 см3 разбавленного раствора К2Сг2O7, 1 см3 2 М
H2 SO4 и 1 см этанола. Смесь осторожно нагреть. Как изменяется цвет раствора? Обратить внимание на характерный запах ацетальдегида (запах прелых яблок). Реакция протекает по уравнению:
ЗСН3СН2OН+К2Сг2О7+4Н2SO4=ЗСН3СНО+К2SO4+Сг2(SO4)3+7Н2O
Опыт №3. Реакция на альдегиды (реакция серебряного зеркала).
В чистую пробирку налить 2 см3 аммиачного раствора оксида серебра [Ag(NH3)2OH и прибавить 3-4 капли раствора формальдегида. Пробирку подогреть на кипящей водяной бане. При этом её стенки покрываются блестящим налётом металлического серебра.
Реакция идёт по уравнению:
HCHO+2[Ag(NH3)2]OH=HCOOH+2Ag  +H 2O+4NH3
+H 2O+4NH3
Контрольные вопросы
1. Чем обусловлены значительные различия в свойствах предельных и непредельных углеводородов?
2. По какому признаку и на какие классы делятся органические соединения?
4. Какие функциональные группы и сколько должны содержать органические вещества, чтобы их можно было использовать для получения полимеров?
Волгодонский инженерно-технический институт – филиал НИЯУ МИФИ
