Способы выражения состава растворов. Коллигативные свойства растворов
Концентрация раствора – это относительное содержание растворенного вещества в растворе.
Рассмотрим некоторые способы выражения концентрации раствора.
− Массовая доля веществаw(Х)
Это безразмерная величина, равная отношению массы растворенного вещества m(X) к общей массе раствора m(р-ра):
w(Х)= 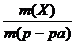 . (2.4.1)
. (2.4.1)
Часто массовую долю выражают в процентах и называют процентной концентрацией по массе:
w %(Х)= 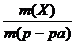 .× 100%. (2.4.2)
.× 100%. (2.4.2)
Массовую долю также можно выражать в промилле (0/00) – это 0,1%; в ррm – это 10-4% и в ррв – это 10-7% (одна часть на миллиард).
Массовая доля вещества, выраженная в процентах, показывает, сколько граммов данного вещества содержится в 100 граммах раствора.
− Молярная концентрация вещества или молярность
Обозначается С(Х). Это отношение количества растворенного вещества n(Х), выраженного в моль, к объему раствора V, выраженному в литрах:
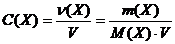 . (2.4.3)
. (2.4.3)
Молярная концентрация выражается в моль/л. В литературе часто встречаются сокращенные обозначения, например запись «1 М раствор» означает раствор, имеющий концентрацию 1моль/л, его еще называют одномолярным раствором.
− Молярная концентрация вещества эквивалента
Обозначается С(1/z X). Эту концентрацию еще называют эквивалентной концентрацией, нормальной концентрацией или нормальностью. Она представляет собой отношение количества вещества эквивалента n(1/z Х), выраженного в моль, к объему раствора V, выраженного в литрах:
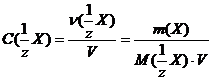 . (2.4.4)
. (2.4.4)
Данная концентрация выражается в моль/л, иногда, чтобы подчеркнуть отличие от молярной концентрации, записывают моль экв./л. Возможны также сокращения, например запись «1н. раствор» означает раствор, в одном литре которого содержится 1моль вещества эквивалента, такой раствор называют однонормальным.
Так как вещества взаимодействуют друг с другом в эквивалентных количествах, то для двух растворов взаимодействующих веществ выполняется равенство
V(X1)×C(1/z1 X1)= V(X2)×C(1/z2 X2) (2.4.5)
Следовательно, растворы равной нормальности реагируют в равных объемах.
− Моляльная концентрация (моляльность)
Обозначается b(Х). Это отношение количества растворенного вещества n(Х), выраженного в моль, к массе растворителя m, выраженной в килограммах:
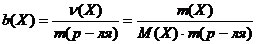 . (2.4.6)
. (2.4.6)
Данная концентрация выражается в моль/кг.
− Титр
Обозначается Т(Х). Это масса растворенного вещества в граммах, содержащаяся в одном миллилитре раствора:
Т(Х)=m(X):V. (2.4.7)
Титр выражается в г/мл (г/см3).
− Молярная доля (мольная доля)
Обозначается 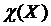 . Представляет собой отношение количества вещества данного компонента, выраженного в моль, к суммарному количеству всех веществ, входящих в состав раствора, включая растворитель:
. Представляет собой отношение количества вещества данного компонента, выраженного в моль, к суммарному количеству всех веществ, входящих в состав раствора, включая растворитель:
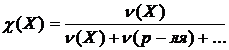 . (2.4.8)
. (2.4.8)
Может быть безразмерной величиной или выражаться в процентах.
− Объемная доля
Обозначается j(Х). Представляет собой отношение объема данного компонента системы к общему объему системы:
j(Х)=V(X):V. (2.4.9)
Может быть безразмерной величиной или выражаться в процентах.
Для перехода от массы раствора к его объему и наоборот нужно знать величину плотности r:
r=m:V. (2.4.10)
Плотность выражается в г/см3 (г/мл), кг/м3, г/л, и в других единицах.
Свойства растворов, которые зависят от числа частиц растворенного вещества и от количества растворителя, но практически не зависят от природы растворенного вещества, называются коллигативными.
К таким свойствам относятся: понижение давления насыщенного пара растворителя над раствором, понижение температуры замерзания (кристаллизации) раствора, повышение температуры кипения раствора по сравнению с чистым растворителем, осмос.
Коллигативные свойства растворов могут проявляться в полной мере лишь в идеальных растворах, в которых нет химического взаимодействия между компонентами, а силы межмолекулярного взаимодействия между частицами растворителя, с одной стороны, и частицами растворенного вещества, с другой стороны, одинаковы. Образование таких растворов не сопровождается тепловым эффектом, и каждый компонент ведет себя независимо от других.
Разбавленные растворы нелетучих неэлектролитов приближаются по своим свойствам к идеальным растворам. Для них можно использовать количественные закономерности, полученные для идеальных растворов. Ниже приводятся аналитические выражения для этих закономерностей.
Закон Рауля
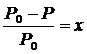 , (2.4.11)
, (2.4.11)
где Р0 – давление насыщенного пара растворителя над чистым растворителем;
Р – давление насыщенного пара растворителя над раствором;
х – мольная доля растворенного вещества.
Следствия из закона Рауля
1) Повышение температуры кипения раствора
DТкип=.КЭб·b, (2.4.12)
где КЭб – эбулиоскопическая постоянная растворителя;
b – моляльная концентрация.
2) Понижение температуры замерзания раствора
DТз.=Кк·b, (2.4.13)
где Кк – криоскопическая постоянная растворителя;
b – моляльная концентрация.
