Силы Ван-дер-Ваальса и составляющие их взаимодействия. Молекулярная, атомная, металлическая и ионная кристаллическая решетка. Расщепление АО в зону. Электропроводимость вещества.
Сила Ван-дер-Ваальса, сила межмолекулярного притяжения, имеет три составляющие. Они обладают несколько отличной физической природой, но их потенциал зависит от расстояния между молекулами одинаково – как 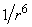 . Это счастливое обстоятельство позволяет непосредственно сравнивать константы взаимодействия, соответствующие трем составляющим силы Ван-дер-Ваальса, причем по причине их одинаковой зависимости от расстояния, пропорция между компонентами будет сохраняться при различных
. Это счастливое обстоятельство позволяет непосредственно сравнивать константы взаимодействия, соответствующие трем составляющим силы Ван-дер-Ваальса, причем по причине их одинаковой зависимости от расстояния, пропорция между компонентами будет сохраняться при различных 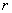 . Сами же константы при множителе
. Сами же константы при множителе 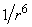 будут отличаться для разных веществ.
будут отличаться для разных веществ.
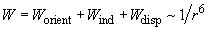 | (1) |
В основе всех трех составляющих силы Ван-дер-Ваальса лежит взаимодействие диполей, поэтому напомним две основные формулы.
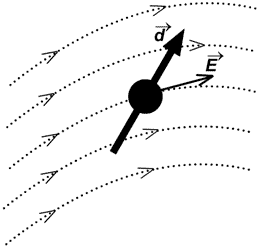 | 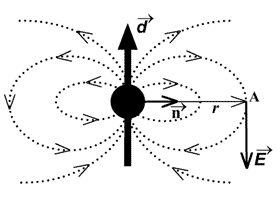 | ||
Энергия диполя 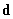 , помещенного в поле , помещенного в поле 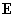 [1]: [1]: | Электрическое поле, создаваемое диполем 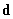 [1]: [1]: | ||
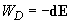 | (2) | 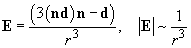 | (3) |
где 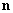 – единичный вектор в направлении на диполь из точки, где ищем поле. – единичный вектор в направлении на диполь из точки, где ищем поле. | |||
В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Кристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служит кристалл хлорида натрия, в котором, как уже отмечалось, каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион - шестью ионами натрия. Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле . Очень часто кристаллические решетки изображают, как показано на рис 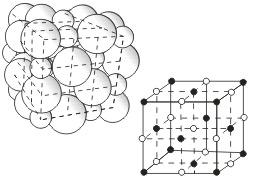 , где указывается только взаимное расположение частиц, но не их размеры.
, где указывается только взаимное расположение частиц, но не их размеры.
Число ближайших соседних частиц, вплотную примыкающих к данной частице в кристалле или в отдельной молекуле, называется координационным числом.
Кристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз - одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. Координационное число углерода в алмазе 4 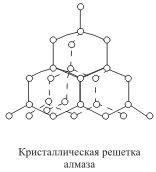 . В решетке алмаза, как и в решетке хлорида натрия, молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Атомная кристаллическая решетка характерна для твердого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
. В решетке алмаза, как и в решетке хлорида натрия, молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Атомная кристаллическая решетка характерна для твердого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
Кристаллические решетки, состоящие из молекул (полярных и неполярных), называются молекулярными.
Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решеткой невелико.
