Атомная единица массы. Относительная атомная масса. Моль, молярная и молекулярная массы. Массовая, объемная и мольная доли.
Уравнение Клапейрона – Менделеева
Молярная масса газов можно вычислить также, пользуясь уравнением идеального газа – уравнением Клапейрога – Менделеева:
pV = mBRT/MB
где p – давление газа, Па; V – его объем; mB – масса вещества, г; MB – его молярная масса, г/моль; T – абсолютная температура, К; R – универсальная газовая постоянна, равная 8,314 Дж/(моль К).
Если объем и давление газа выражены в других единицах измерения, то значение газовой постоянной в уравнении Клапейрона – Менделеева примет другое значение. Оно может быть рассчитано по формуле, вытекающей из объединенного закона газового состояния для моля вещества при нормальных условиях:
R= (pо Vо/Tо)для одного моля газа
Строение атома. Ранние модели атома. Постулаты Бора.
Атом (от др.-греч. ἄτομος — неделимый) — наименьшая химически неделимая часть химического элемента, являющаяся носителем его свойств[1]. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонови незаряженных нейтронов, а окружающее его облако состоит из отрицательно заряженных электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов — изотопу этого элемента.
Дж. Дж. Томсон (Около 1900 г.) предлагает первую модель атома, согласно которой положительный заряд равномерно заполняет весь объем атома, а отрицательный, представленный электронами, вкраплен в эту положительно заряженную сферу. Эта модель получила название «пудинг Томсона».
Ранняя планетарная модель атома Нагаоки. В 1904 году японский физик Хантаро Нагаока
предложил модель атома, построенную по аналогии с планетой Сатурн. В этой модели вокруг маленького положительного ядра по орбитам вращались электроны, объединённые в кольца. Модель оказалось ошибочной, но некоторые важные её положения вошли в модель Резерфорда.[источник не указан 600 дней]Планетарная модель атома Бора-Резерфорда. В 1911 году [11] Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а, следовательно, терять энергию. Расчёты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора-Резерфорда»). Постулаты Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
Постулаты
Модель атома Бора
· Электрон в атоме, не теряя энергии, двигается по определённым дискретным круговым орбитам для которых момент импульса квантуется: 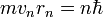 , где n - натуральные числа, а
, где n - натуральные числа, а 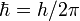 - постоянная Планка. Пребывание электрона на орбите определяет энергию этихстационарных состояний
- постоянная Планка. Пребывание электрона на орбите определяет энергию этихстационарных состояний
· При переходе электрона с орбиты на орбиту излучается или поглощается квант энергии hν = En − Em, где En;Em — энергетические уровни, между которыми осуществляется переход. При переходе с верхнего уровня на нижний энергия излучается, при переходе с нижнего на верхний — поглощается.
Используя данные постулаты и законы классической механики, Бор предложил модель атома, ныне именуемуюБоровской моделью атома[1]. В дальнейшем Зоммерфельд расширил теорию Бора на случай эллиптических орбит. Её называют моделью Бора-Зоммерфельда.
5. Состояние электронов в атоме. Квантовые числа. Геометрическая интерпретация главного, орбитального и магнитного квантовых чисел.
Состояние каждого электрона в атоме обычно описывают с помощью четырех квантовых чисел: главного (n), орбитального (l), магнитного (m) и спинового (s). Первые три характеризуют движение электрона в пространстве, а четвертое - вокруг собственной оси.
Главное квантовое число (n). Определяет энергетический уровень электрона, удаленность уровня от ядра, размер электронного облака. Принимает целые значения (n = 1, 2, 3 ...) и соответствует номеру периода. Из периодической системы для любого элемента по номеру периода можно определить число энергетических уровней атома и какой энергетический уровень является внешним.
Пример.
Элемент кадмий Cd расположен в пятом периоде, значит n = 5. В его атоме электроны раcпределены по пяти энергетическим уровням (n = 1, n = 2, n = 3, n = 4, n = 5); внешним будет пятый уровень (n = 5).
Орбитальное квантовое число (l) характеризует геометрическую форму орбитали. Принимает значение целых чисел от 0 до (n - 1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы. Набор орбиталей с одинаковыми значениями n называется энергетическим уровнем, cодинаковыми n и l - подуровнем.
Для
l=0 s- подуровень, s- орбиталь – орбиталь сфера
l=1 p- подуровень, p- орбиталь – орбиталь гантель
l=2 d- подуровень, d- орбиталь – орбиталь сложной формы
f-подуровень, f-орбиталь – орбиталь еще более сложной формы
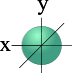 | 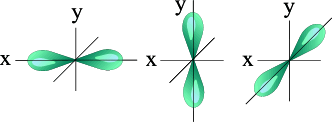 |
| S - орбиталь | Три p – орбитали |
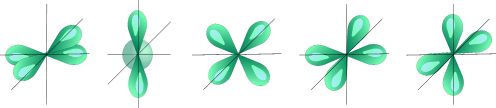 |
| Пять d – орбиталей |
И разность
атомных волновых функций с коэффициентами, указывающими на долю их вклада в образование МО.
Связывающие и разрыхляющие молекулярные орбитали.
Связывающая МО образуется при сложении атомных орбиталей , ее
энергия понижается относительно энергий АО.
Волновая функция, соответствующая связывающей орбитали,
получается в результате сложения волновых функций с одинаковым
знаком.
Электронная плотность при этом концентрируется между ядрами,
и волновая функция принимает положительное значение.
При вычитании атомных орбиталей энергия МО повышается –
образуется разрыхляющая орбиталь. Электронная плотность
располагается за ядрами, а между ними равна нулю.
Волновая функция в двух образовавшихся электронных облаках
имеет противоположные знаки
правила:
1. Электроны в молекуле, как и в атоме, занимают соответствующие
орбитали, характеризующиеся своим набором квантовых чисел;
2. Число образующихся МО равно числу АО, участвующих в их образовании;
3. Распределение электронов по МО подчиняется принципу наименьшей
энергии (Клечковского), принципу Паули и правилу Хунда;
4. Для гомоядерных молекул выигрыш в энергии за счет образования
связывающей орбитали компенсируется повышением энергии
разрыхляющей орбитали
5. В гетероядерных (разно элементных) молекулах связывающие орбитали
по энергии ближе к орбиталям более электроотрицательного атома (B),
а разрыхляющие – к орбитали менее электроотрицательного атома (A)
6. Кратность химической связи равна половине разности числа электронов, расположенных на связывающих орбиталях, и числа электронов на разрыхляющих.
9.Типы орбиталей. Схемы образования σ- и π- молекулярных орбиталей. Условия образования связывающей, не связывающей и разрыхляющей МО в рамках метода МО.
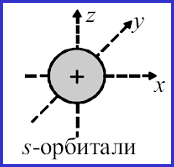
К настоящему моменту описано пять типов орбиталей: s, p, d, f и g. Названия первых трех сложились исторически, далее был выбран алфавитный принцип. Формы орбиталей вычислены методами квантовой химии. s-Орбитали имеют сферическую форму и, следовательно, одинаковую электронную плотность в направлении каждой оси трехмерных координат:
S-орбитали
Орбитальному квантовому числу l = 0 соответствует единственное значение магнитного квантового числа ml = 0. Эти значения характеризуют все s-орбитали.
т. к. в этом случае магнитное квантовое число принимает только
одно значение, каждый s-подуровень состоит только
из одной орбитали.
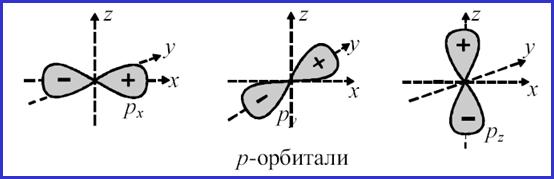
Р-орбитали
• Рассмотрим любой p-подуровень: при l = 1
• орбитали имеют форму гантелей (объемные «восьмерки»),
• магнитное квантовое число принимает следующие значения ml = – 1, 0, + 1 (три значения), следовательно,
• p-подуровень состоит из трех орбиталей, и эти орбитали располагаются вдоль трех осей координат и, соответственно, обозначаются px, py, pz
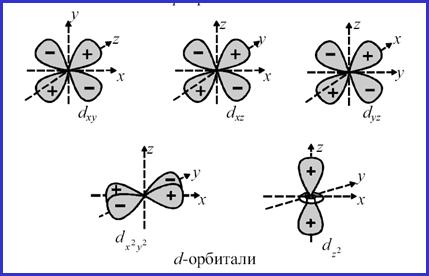
D-орбитали
Для d-подуровня
l = 2, ml = – 2, – 1, 0, + 1, + 2 (5 значений), и любой
d-подуровень состоит из 5 орбиталей, которые определенным
образом расположены в пространстве и соответственно
обозначаются dxy, dxz, dzy, dz2 и dx2-y2
σ-связь:
1) Образуют S- и р - электроны
2) Имеет цилиндрическую симметрию
3) Имеют один максимум электронной плотности
S-Электроны образуют s-связь в результате перекрывания со следующими электронами другого атома:
s–, pX–, dx2-y2 – электронами.
Когда происходит перекрывание в областях, где электронная плотность
имеет противоположные знаки – образуется не связывающая орбиталь.
π-связи:
1) возникают при перекрывании электронных облаков над и под
линией, соединяющей центры атомов.
2) Не имеют цилиндрической симметрии
3) Имеют 2 максимума электронной плотности
π-связь образуют электроны на таких парах орбиталей
как pY – pY, pZ – pZ, py – dXY
Теория молекулярных орбиталей (МО) дает представление о распределении электронной плотности и объясняет свойства молекул.
Связывающая МО образуется при сложении атомных орбиталей , ее
энергия понижается относительно энергий АО.
Волновая функция, соответствующая связывающей орбитали,
получается в результате сложения волновых функций с одинаковым
знаком.
Электронная плотность при этом концентрируется между ядрами,
и волновая функция принимает положительное значение.
При вычитании атомных орбиталей энергия МО повышается –
образуется разрыхляющая орбиталь. Электронная плотность
располагается за ядрами, а между ними равна нулю.
Волновая функция в двух образовавшихся электронных облаках
имеет противоположные знаки
Не связывающая орбиталь
Образуется, когда АО одного из атомов вследствие большой разницы в энергии или симметрии не может взаимодействовать с АО другого атома. ОНА переходит в энергетическую схему МО молекулы с энергией, соответствующей ей в атоме.
Насыщаемость и направленность связей. Полярность и поляризуемость связей. Типы связей, типы кристаллических решеток. Силы Ван-дер-Ваальса. Влияние характера связей на физико-химические свойства веществ.
Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т.е. их способностью к образованию строго определенного числа связей, которое обычно лежит в пределах от 1 до 6. Общее число валентных орбиталей в атоме, т.е. тех, которые могут быть использованы для образования химических связей, определяет максимально возможную валентность элемента. Число уже использованных для этого орбиталей определяет валентность элемента в данном соединении.
Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами. Это достигается при такой пространственной направленности перекрывания
электронных облаков, которая совпадает с их собственной. Исключение составляют s-электронные облака, поскольку их сферическая форма делает все направления равноценными. Для p- и d-электронных облаков перекрывание осуществляется вдоль оси, по которой они вытянуты, а образующаяся при этом связь называется s-связью. s-Связь имеет осевую симметрию, и оба атома могут вращаться вдоль линии связи, т.е. той воображаемой линии, которая проходит через ядра химически связанных атомов.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Кристалли́ческая решётка
Ионные, атомные, молекулярные, металлические.
Ван-дер-ваальсовы силы — силы межмолекулярного взаимодействия с энергией 0,8 — 8,16 кДж/моль Этим термином первоначально обозначались все такие силы, но сейчас он обычно применяется к силам, возникающим при поляризации молекул и образовании диполей. Открыты Я. Д. ван дер Ваальсом в 1869 году.
*К ван-дер-ваальсовым силам относятся взаимодействия между диполями (постоянными и индуцированными). Название связано с тем фактом, что эти силы являются причиной поправки на внутреннее давление в уравнении состояния реального газа Ван-дер-Ваальса. Эти взаимодействия в основном определяют силы, ответственные за формирование пространственной структуры биологических макромолекул.
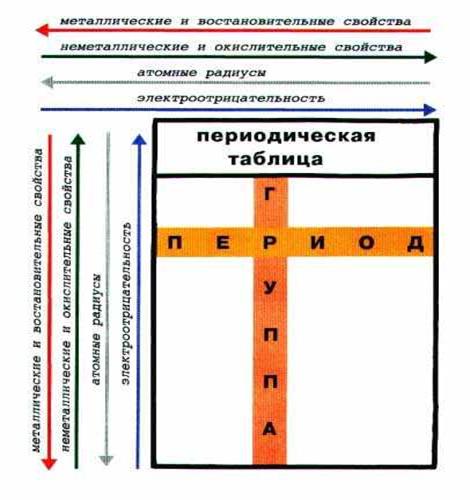
14. Закономерности изменения свойств атомов в периодах и группах периодической системы Д. И. Менделеева. Периодичность свойств элементов (размер атомов, энергия ионизации, сродство к электрону).
15. Химическая термодинамика. Основные понятия и определения. Система, термодинамические процессы, переменные и функции.
Хими́ческая термодина́мика — раздел физической химии, изучающий процессы взаимодействия веществ методами термодинамики.
Основными направлениями химической термодинамики являются:
1. Классическая химическая термодинамика, изучающая термодинамическое равновесие вообще.
2. Термохимия, изучающая тепловые эффекты, сопровождающие химические реакции.
3. Теория растворов, моделирующую термодинамические свойства вещества исходя из представлений о молекулярном строении и данных о межмолекулярном взаимодействии.
Химическая термодинамика тесно соприкасается с такими разделами химии, как: аналитическая химия; электрохимия; коллоидная химия; адсорбция и хроматография.
Атомная единица массы. Относительная атомная масса. Моль, молярная и молекулярная массы. Массовая, объемная и мольная доли.
Атомная единица массы (а.е.м.) равна 1/12 массы m атома углерода 12С (m одного атома 12С равна 1,993× кг).
Относительная атомная масса-это безразмерная величина, равная отношению массы m молекулы вещества к 1/12 массы атома 12С: 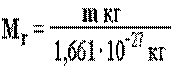
Моль - это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро (NA= 6,02× моль-1).
Молярная масса вещества (M) – масса одного моля этого вещества.
По величине она равна относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar). Молярная масса имеет размерность г/моль.
Относительная молекулярная масса равна сумме относительных масс атомов, входящих в состав молекулы
Массовая доля вещества А в системе – отношение его массы к массе всей системы (часто эту величину выражают в %):
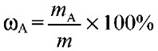
Все задачи, связанные с расчетами по массовым долям, следует решать, используя эту формулу. Чтобы избежать досадных технических ошибок, рекомендуем при проведении расчетов сразу же % перевести в доли.
Объемная доля компонента – отношение объема компонента к объему всей системы:
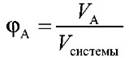
Мольная доля компонента – отношение количества вещества (моль) компонента А к общему количеству молей всех компонентов системы:
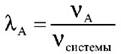
3. Количественные соотношения в химии. Стехиометрические законы: закон сохранения массы, закон постоянства состава (дальтониды и бертоллиды), закон кратных отношений. Газовые законы: закон Авогадро, уравнение Менделеева-Клапейрона.
Закон сохранения массы:
Масса вещества, вступающих в реакцию, равна массе веществ, образующихся в результате реакции.
Благодаря этому закону, открытому М. В. Ломоносовым в 1748-1756гг., химия перешла от науки качественной к количественной. В производстве на этой основе ведутся расчеты материальных балансов.
Закон постоянства состава:
Любое химически индивидуальное соединение имеет один и тот же количественный состав независимо от способа его получения.
Это значит, что соотношения между массами элементов, входящих в состав соединения, постоянны. Закон всегда выполняется для газообразных и жидких веществ. Для вещества, находящегося в твердом состоянии, закон не справедлив. Это связано с тем, что в кристаллической структуре любого твердого вещества всегда, в той или иной мере, имеются пустоты, не заполненные атомами, примесные атомы др элементов и другие отклонения от идеальной структуре. На все это, наряду с температурой, давлением, концентрациями веществ, влияет очень большое число других факторов, связанные уже с технологией получения, выделения и очистки вещества. Обычная вода содержит 11% водорода, а тяжелая - почти в два раза больше, 20%.
Закон кратных отношений:
Если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа (Дж. Дальтон, 1808г).
Так, углерод образует с кислородом два соединения. Одно из них – оксид углерода – содержит 42,88% (масс.) углерода и 57,12% (масс.) кислорода. Второе соединение – диоксид углерода – содержит 27,29% (масс.) углерода и 72,71% (масс.) кислорода. Подсчитаем массу кислорода, соединяющуюся с одним и тем же количеством углерода при образовании оксидов. Для этого разделим друг на друга величины, выражающие содержание кислорода и углерода в том и другом оксидах. Получим, что на одну единицу массы углерода в диоксиде углерода приходится ровно в 2 раза больше кислорода, чем в оксиде углерода (2).
Закон кратных отношений, как и закон постоянства состава, не является всеобщим и, также не справедлив для веществ в твердом состоянии.
Закон Авогадро:
В равных объемах любых газов, взятых при одной и той же температуре и при одинаковом давлении, содержится одно и тоже число молекул.
(1811г.) закон Авогадро позволил сделать выводы о числе атомов в молекулах газах например, таких, как водород, хлор, кислород, азот. Закон применим и для заряженных частиц в газовой фазе (электронов, ионов), если из концентрация невелика, а воздействие магнитных и электрических полей можно пренебречь.
