Химическая идентификация вещества
Общие понятия. Химическая идентификация (обнаружение) - это установление вида и состояния фаз, молекул, атомов, ионов и других составных частей вещества на основе сопоставления экспериментальных и соответствующих справочных данных для известных веществ Идентификация является целью качественного анализа. При идентификации обычно определяется комплекс свойств веществ: цвет, фазовое состояние, плотность, вязкость, температуры плавления, кипения и фазового перехода, растворимость, электродный потенциал, энергия ионизации и (или) др. Для облегчения идентификации созданы банки химических и физико - химических данных. При анализе многокомпонентных веществ все более используются универсальные приборы (спектрометры, спектрофотометры, хроматографы, полярографы и др.), снабженные компьютерами, в памяти которых имеется справочная химико-аналитическая информация. На базе этих универсальных установок создается автоматизированная система анализа и обработки информации.
В зависимости от вида идентифицируемых частиц различают элементный, молекулярный, изотопный и фазовый анализы. В настоящей главе будут рассмотрены в основном элементный и молекулярный анализы.
В зависимости от массы сухого вещества или объема раствора анализируемого вещества различают макрометод (0,5 - 10 г или 10 - 100 мл), полумикрометод (10 - 50 мг или 1 - 5 мл), микрометод (1 - 5 мг или 0,1 - 0,5 мл) и ультрамикрометод (ниже 1 мг или 0,1 мл) идентификации.
Качественный анализ характеризуется пределом обнаружения (обнаруженным минимумом) сухого вещества, т.е. минимальным количеством надежно идентифицируемого вещества, и предельной концентрацией раствора cx,min .Эти две величины связаны друг с другом соотношением
cx,min = 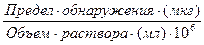
В качественном анализе применяются только такие реакции, пределы обнаружения которых не превышают 50 мкг.
Имеются некоторые реакции, которые позволяют обнаружить то или иное вещество или ион в присутствии других веществ или других ионов. Такие реакции называются специфическими. Примером таких реакций могут быть обнаружение ионов NH 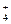 действием щелочи или нагреванием,
действием щелочи или нагреванием,
NH4Cl + NaOH = NH3↑ + Н2O + NaCl
реакция йода с крахмалом с темно-синим окрашиванием, обнаружение NO 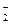 с помощью реакции со смесью сульфаниловой кислоты H [SO3С6Н4NH2] и
с помощью реакции со смесью сульфаниловой кислоты H [SO3С6Н4NH2] и 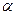 - нафтиламина C10H7NH2, в результате которой появляется красное окрашивание и др.
- нафтиламина C10H7NH2, в результате которой появляется красное окрашивание и др.
Однако в большинстве случаев реакции обнаружения вещества не являются специфическими, поэтому мешающие идентификации вещества переводят в осадок, слабодиссоциирующее или комплексное соединение. Анализ неизвестного вещества проводят в определенной последовательности, при которой то или иное вещество идентифицируют после обнаружения и удаления, мешающих анализу других веществ, т.е. применяют не только реакции обнаружения веществ, но и реакции отделения их друг от друга.
Так как свойства вещества зависят от его чистоты, необходимо кратко остановиться на этом вопросе.
Чистота веществ. Элементное вещество или соединение содержит основной (главный) компонент и примеси (посторонние вещества). Если примеси содержатся в очень малых количествах, то их называют «следами». Термины отвечают молярным долям в %: «следы» 10-3 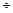 10-1, «микроследы» - 10-6
10-1, «микроследы» - 10-6 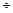 10-3, «ультрамикроследы» - 10-9
10-3, «ультрамикроследы» - 10-9 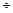 10-6, субмикроследы - менее 10-9. Вещество называется высокочистым при содержании примесей не более 10-4
10-6, субмикроследы - менее 10-9. Вещество называется высокочистым при содержании примесей не более 10-4 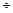 10-3 % (мол. доли) и особо чистым (ультрачистым) при содержании примесей ниже 10-7 % (мол. доли). Имеется и другое определение особо чистых вещества, согласно которому они содержат примеси в таких количествах, которые не влияют на основные специфические свойства веществ. Так согласно этому определению особо чистые редкоземельные металлы содержат примесей не более 10-1 % (ат. доли), в то время как особо чистый (полупроводниковый) германий - не более 10-7 % (ат. доли). Поэтому значение имеет не любая примесь, а примеси, оказывающие влияние на свойства чистого вещества. Такие примеси называются лимитирующими или контролирующими примесями.
10-3 % (мол. доли) и особо чистым (ультрачистым) при содержании примесей ниже 10-7 % (мол. доли). Имеется и другое определение особо чистых вещества, согласно которому они содержат примеси в таких количествах, которые не влияют на основные специфические свойства веществ. Так согласно этому определению особо чистые редкоземельные металлы содержат примесей не более 10-1 % (ат. доли), в то время как особо чистый (полупроводниковый) германий - не более 10-7 % (ат. доли). Поэтому значение имеет не любая примесь, а примеси, оказывающие влияние на свойства чистого вещества. Такие примеси называются лимитирующими или контролирующими примесями.
Следует отметить, что определение степени чистотьг часто зависит от наименьшей суммарной концентрации примесей, которую удается обнаружить. Например, спектрально чистыми называют вещества, примеси в которых можно определить спектральными методами.
Особо чистым веществам присваиваются определенные марки, которыми характеризуют число видов и логарифм массовой доли лимитирующих примесей (%). Например, марка ОСЧ 8 - 6 означает, что вещества особой чисто
ты содержат 8 лимитирующих видов примесей, причем суммарная их концентрация не превышает 10-6 % (масс. долей). При наличии органических примесей их обозначают индексом «ОП» и указывают логарифм их массовой доли (%). Например, марка ОП – 5 - ОСЧ означает, что суммарное содержание органических примесей не превышает 10-5 % (массовых долей).
Идентификация катионов неорганических веществ. Методы качественного анализа базируются на ионных реакциях, которые позволяют идентифицировать элементы в форме тех или иных ионов. В ходе реакций образуются труднорастворимые соединения, окрашенные комплексные соединения происходит окисление или восстановление с изменением цвета раствора.
Для идентификации с помощью образования труднорастворимых соединений используют как групповые, так и индивидуальные осадители. Групповыми осадителями для ионов Ag+, Pb2+, Hg2+ служит NaCl; для ионов Са2+, Sr2+, Ва2+ - (NH4)2CO3, для ионов А13+, Сr3+, Fе2+, Fe3+, Mn2+, Со2+, Ni2+, Zn2+ и др. - (NH4)2S
Если присутствует несколько катионов, то проводят дробный анализ, при котором осаждаются все труднорастворимые соединения, а затем обнаруживаются оставшиеся катионы тем или иным методом, либо проводят ступенчатое добавление реагента, при котором сначала осаждаются соединения с наименьшим значением ПР, а затем соединения с более высоким значением ПР.
Любой катион можно идентифицировать с помощью определенной реакции, если удалить другие катионы, мешающие этой идентификации.
Имеется много органических и неорганических реагентов, образующих осадки или окрашенные комплексные соединения с катионами (табл. 7).
Летучие соединения металлов окрашивают пламя горелки в тот или иной цвет. Поэтому, если внести изучаемое вещество на платиновой или нихромовой проволоке в бесцветное пламя горелки, то происходит окрашивание пламени в присутствии в веществе тех или иных элементов, например, в цвета: ярко - желтый (натрий), фиолетовый (калий), кирпично – крас-
ный (кальций), карминово - красный (стронций), желто - зеленый (медь или бор), бледно - голубой (свинец или мышьяк).
Идентификация анионов. Анионы обычно классифицируют по растворимости солей, либо по окислительно - восстановительным свойствам. Так многие анионы (SO 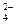 , SO
, SO 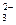 , СО
, СО 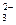 , SiO
, SiO 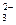 , F -, РО
, F -, РО 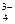 , CrO
, CrO 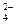 и др.) имеют групповой реагент ВаСl2 в нейтральной или слабо кислой среде, так как соли бария и этих анионов мало растворимы в воде.
и др.) имеют групповой реагент ВаСl2 в нейтральной или слабо кислой среде, так как соли бария и этих анионов мало растворимы в воде.
Таблица 14
Некоторые реагенты для идентификации катионов
| Реагент | Формула | Катион | Продукт реакции |
| Ализарин | С14H6O2 (OH)2 | Аl3+ | Ярко - красный осадок |
| Бензидин | C12H8 (NH2)2 | Cr (VI); Mn (VII) | Соединение синего цвета |
| Гексагидрооксостибиат калия | K [Sb (OH)6] | Na+ | Белый осадок |
| Гексанитрокобальтат натрия | Na3Co (NO2)6 | K+ | Желтый осадок |
| Гексацианоферрат (П) калия | K4 [Fe (CN)6] | Fe3+ Cu2+ | Темно - синий осадок Красно - бурый осадок |
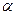 - Диметилглиоксим - Диметилглиоксим | C4N2H8O2 | Ni2+, Fe2+, Pd2+ | Ярко - красный осадок |
| Дипикриламин | [C6H2 (NO2)3]2 NH | K+ | Оранжево – красный осадок |
| Дитизон в хлороформе | C13H12N4S | Zn2+ | Малиново – красный раствор |
| Дихромат калия | K2Cr2O7 | Ca2+ | Оранжевый осадок |
| Магнезон ИРЕА | C16H10O5N2SClNa | Mg2+ | Ярко - красная окраска раствора |
| Мурексид | C8H6N6O6 | Ca2+ Sr2+, Ba2+ | Раствор красного цвета Раствор фиолетового цвета |
| Родамин Б | C24H21O3N2Cl | [SbCl6] - | Раствор синего цвета |
| Хромоген черный | C20H13O7N3S | Mg2+ | Раствор винно - красного цвета |
Групповым реагентом в растворе HNO3 на ионы Сl - , Вr -, I -, SCN -, CN -, S 2-, ClO -, [Fe (CN)6] 4- и др. служит AgNO3. Классификация анионов по окислительно - восстановительным свойствам приведена в табл. 8
Таблица 15
Классификация анионов по
окислительно - восстановительным свойствам
| Групповой реагент | Анионы | Групповой признак |
| Восстановители Сl - , Вr -, I -, SCN - | Обесцвечивание раствора | |
| КМnO4 + H2SO4 I2, крахмал + H2SO4 | C2O 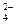 , S2-, SO , S2-, SO 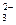 , NO , NO 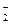 S2-, SO S2-, SO 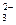 , S2O , S2O 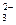 | Обесцвечивание раствора |
| КI + H2SO4 + (крахмал) | Окислители CrO 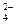 , MnO , MnO 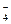 , СlO – ClO , СlO – ClO 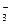 , NO , NO 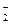 , BrO , BrO 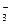 | Окрашивание раствора |
| МnСl2 + HCl (конц) | NO 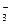 , CrO , CrO 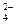 , NO , NO 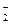 , ClO , ClO 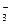 [Fe (CN)6] 3-, СlO –, MnO [Fe (CN)6] 3-, СlO –, MnO 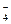 | Окрашивание раствора |
Инертные СО 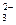 , SO , SO 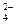 , SiO , SiO 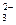 , PO , PO 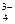 , F-, BO , F-, BO 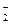 |
Анионы можно обнаружить дробным анализом. Для этого групповой реагент ступенчато приливают к анализируемому раствору, первыми выпадают в осадок соединения с наименьшими значениями ПР. Отдельные ионы могут быть обнаружены с помощью тех или иных специфических реакций или реагентов. Например, при воздействии на анионы СО 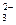 с кислотой протекает реакция с выделением пузырьков диоксида углерода:
с кислотой протекает реакция с выделением пузырьков диоксида углерода:
CO 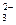 + 2H+
+ 2H+ 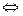 H2CO3
H2CO3 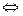 H2O + CO2
H2O + CO2
Как и для катионов, имеются реагенты на те или иные анионы (табл. 9).
Таблица 16
Некоторые реагенты для идентификации анионов
| Реагент | Формула | Ион | Продукты реакции |
| Антипирин, 5 % - ный в H2SO4 | C6H5C3HON2 (CH3)2 | NO 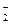 | Раствор ярко – зеленого цвета |
NO 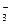 | Раствор ярко - красного цвета | ||
| Дифениламин в H2SO4 | (С6Н5)2NН | NO 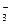 | Раствор темно - синего цвета |
| Парамолибдат аммония в HNO3 | (NH4)6Mo7O24 ∙ 4H2O | PO 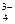 | Желтый осадок |
| Родоизонат бария | - | SO 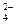 | Обесцвечивание раствора |
Таким образом, химическая идентификация вещества базируется в основном на реакциях осаждения, комплексообразования, окисления и восстановления, нейтрализации, при которых происходит выпадение белого или окрашенного осадка, изменение цвета раствора или выделение газообразных веществ.
Количественный анализ
Задачей количественного анализа является определение количественного содержания элементов, ионов или химических соединений, входящих в состав исследуемых веществ и материалов.
Результаты анализа обычно выражают в процентах. Например, при анализе карбоната кальция указывают, сколько процентов кальция, углерода и кислорода в нем содержит содержится. Ввиду того, что CaCO3 можно рассматривать как продукт соединения окиси кальция CaO с угольным ангидридом CO2, состав этой соли часто выражают также в процентах окислов CaO и CO2.
Химический анализ является важнейшим методом исследования и широко применяется во всех областях науки, которые так или иначе соприкасаются с химией. Так, огромно его значение для минералогии, геологии, физиологии, микробиологии, медицинских, агрономических и технических наук. Не менее важное значение имеет химический анализ и в производстве. Инженер-технолог на любой стадии производственного процесса должен знать как качественный, так и количественный состав материалов, подвергающихся переработке. Например, правильно составить шихту в чугунолитейном или стекольном производстве можно, только зная состав загружаемых в печь материалов, наилучшим образом провести процесс дубления кожи можно, только зная содержание дубильных веществ в применяемых экстрактах и т.д.
Методы количественного анализа.В количественном анализе обычно используют те же самые реакции ионов, которые применяются в качественном анализе. Так, для количественного определения хлора (вернее Cl - иона) его осаждают из раствора ионом серебра:
Cl- + Ag+ = AgCl
На основе этой реакции хлор можно определять различными способами. Можно, например, осадок AgCl, осторожно прокалить (или высушить) и точно взвесить. По весу осадка AgCl и его формуле нетрудно вычислить, сколько в нем содержится хлора. Так, например, при анализе 0,0536 г. NaCl осадок весил 0,1290 г.. Принимая во внимание, что грамм-моль (т.е. 143,3 г.) AgCl содержит г- атом (т.е. 35,45 г.) Cl, можно записать:
в 143,3г. AgCl содержится 35,45 г. Cl
в 0,1290 г. AgCl содержится. x г. Cl
х = 0,1290 35,45/143,3 г.
Учитывая, что весь найденный хлор содержался раньше во взятой навеске (т.е. в отвешенном для анализа количестве) NaCl легко вычислить процентное содержание хлора в последней.
в 0,0536 г. NaCl содержится. 0,03192 г. Cl
в 100 г. NaCl содержится уг. Cl
у = 0,03192∙100 / 0,0536 = 69,6 %
Такой метод анализа называется весовым анализом, поскольку о количестве определяемого элемента судят по весу продукта реакции. Определить количество хлора в NaCl можно однако и иначе, а именно - при помощи так называемого титрования, т.е. измерения объема раствора реактива AgNO3 точно известной концентрации, затрачиваемого на осаждение ионов Cl-. Этих двух величин - объема и концентрации раствора реактива - вполне достаточно для вычисления искомого содер-
жания хлора в исследуемом веществе. Если, например, на осаждение всего хлора из раствора, полученного при растворении навески вещества в воде, потребовалось 18 мл раствора AgNO3, в 1 мл которого содержится 0,0085 г. этой соли, то всего на реакцию очевидно затрачено 18·0,0085, т.е. 0,1530 г. AgNO3.
Из уравнения реакции NaCl + AgNO3 = AgCl + NaNO3 видно, что на осаждение 1 г-иона (т.е. 35,45 г.) Cl затрачивается 1 г-моль (т.е. 169,9 г.) AgNO3
Поэтому можно написать:
на осаждение 35,45 г. Cl затрачивается 169,9 г. AgNO3
на осаждение х г. Cl затрачивается 0,1530 г. AgNO3
х = 0,1530∙35,45/169,9 = 0,03192 г. Cl
После того, как и в предыдущем случае, остается рассчитать процентное содержание хлора во взятой навеске.
Метод анализа, основанный на точном измерении объема раствора реактива точно известной концентрации, затрачиваемого на реакцию, называется объемным анализом
Объемный анализ имеет в отношении скорости выполнения огромное преимущество перед весовым анализом. Ускорение определений достигается здесь благодаря тому, что вместо взвешивания продукта реакции при объемном анализе измеряют объем затрачиваемого на ее течение раствора реактива, концентрация (или, как говорят титр) которого всегда точно известна.
Титром называется число граммов растворенного вещества, содержащееся в 1 мл раствора. Например, выражение “титр H2SO4 равен 0,0049 г./мл” означает, что каждый миллиметр данного раствора серной кислоты содержит 0,0049 г. H2SO4, титр обозначается буквой Т с указанием формулы соответствующего вещества. Так, в данном случае:
Т(H2SO4) = 0,0049 г/мл.
Раствор, титр которого точно известен, называется титрованным
При анализе титрованный раствор реактива наливают в измерительный сосуд, называемый бюреткой, и понемногу приливают его к исследуемому раствору до тех пор, пока тем или иным способом не будет установлено, что затрачиваемое количество реактива эквивалентно количеству определяемого вещества. Эта операция носит название титрования.
Отсчитав на бюретке, израсходованный на титрование, объем раствора реактива и зная его титр, перемножают эти величины и получают израсходованное на реакцию количество
реактива в г. Отсюда по уравнению реакции уже нетрудно вычислить количество определяемого вещества в исследуемом растворе, а если известен объем последнего, то и титр раствора.
Одно из наиболее существенных отличий объемного анализа от весового заключается в том, что при титровании употребляют не избыток раствора, а количество его, точно отвечающее уравнению реакции и химически эквивалентное количеству определяемого вещества.
Отсюда ясно, что при титровании необходимо достаточно точно установить момент наступления эквивалентности или, как говорят, фиксировать точку эквивалентности.
В некоторых случаях такое фиксирование оказывается возможным благодаря тому, что окрашенный реактив в процессе реакции меняет свою окраску. Например, если подкисленный серной кислотой раствор FeSO4 титровать раствором KMnO4, то протекает реакция:
10FeSO4 + 2 KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
При этом окраска прибавляемой капли KMnO4 почти мгновенно исчезает. Это обусловлено восстановлением ионами Fe2+ окрашенных ионов MnO4- в бесцветные ионы Mn2+. Но как только весь FeSO4 будет окислен до Fe2 (SO4)3 одна лиш-
няя капля KMnO4 окрасит раствор в бледномалиновый цвет; это показывает, что точка эквивалентности уже перейдена и титрование нужно закончить. Таким образом, его заканчиваютздесь не строго в точке эквивалентности, а несколько “перетитровывают”, т.е. вводят с последней каплей титрованного раствора небольшой избыток KMnO4. Вследствие этого возникает некоторая погрешность, называемая ошибкой титрования. Так как титрованный раствор KMnO4 очень разбавлен и избыток его не превышает одной капли, эта ошибка мала и с ней можно не учитывать.
Таким образом, необходимым условием для применения объемного метода анализа является возможность тем или иным способом фиксировать точку эквивалентности.
Вторым необходимым условием для применения реакции в объемном анализе является количественное течение ее, характеризуемое соответствующей величиной константы равновесия реакции. Эта константа должна быть достаточно велика.
Кроме того, необходимо, чтобы при титровании не должны протекать побочные реакции, делающее точное вычисление результатов анализа невозможным.
Вычисления результатов объемных определений.Вычисление при выражении концентраций через нормальность.
Ход вычислений различен в зависимости от того, каким методом пользуются при определении - методом пипетирования или методом точных навесок.
Вычисление при методе пипетирования.
Сколько было Ba(OH)2 , если после растворения его в мерной колбе емкостью 250 мл и разбавлении раствора водой до метки на титрование 20 мл полученного раствора израсходовано 22,4 мл 0,009884 н. раствора HCl.
Для вычислений используется закон:
Произведение объема раствора, затрачиваемого при титровании, на его нормальность есть величина постоянная для обоих реагирующих веществ.
N1 × V1 = N1 × V1
