Классификация веществ, применяемых в сельском хозяйстве
Вещества, применяемые в сельском хозяйстве, можно разделить на две основные группы: пестициды и удобрения. Пестицидами называются химические вещества, применяемые для борьбы с вредными организмами (насекомыми, бактериями и т. д.).
По степени пожарной опасности химические вещества, применяемые в сельском хозяйстве, можно разделить на следующие группы:
1) взрывоопасные — вещества, способные взрываться или детонировать без участия кислорода воздуха. К ним относятся динитроортокрезол, аммиачная и калийная селитры и др. Эти вещества могут взрываться при резком нагревании, что может быть при пожаре, а также под действием детонации — взрыва другого взрывчатого вещества. К этой же группе можно отнести и_сильные окислители. Многие из веществ этой группы, являясь сильными окислителями, могут вызвать самовозгорание горючих веществ при совместном храпении и транспортировании;
2) легковоспламеняющиеся — вещества (материалы, смеси), способные воспламеняться от кратковременного действия источника зажигания с низкой энергией (искры, накаленные тела и т. п.). К таким веществам можно от-
нести бутанон, гербицид 2,4-ДА, дихлорэтан, керосин тракторный, хлорсмесь, цинеб, аммиак и др. Вещества этой группы являются газообразными или жидкими, имеют низкую температуру вспышки, как правило, ниже
обычно (20 — 25 °С), летучи; могут самовозгораться при смешивании с окислителями. Пары их с воздухом образуют смеси, способные к воспламенению при наличии источника зажигания;
3) горючие — вещества, способные к самостоятельному горению после удаления источника зажигания. Это севин, сера, симазин, фосфамид, хлорофос 80 %-ный и др. Вещества этой группы по агрегатному состоянию бывают жидкими или твердыми. Пыль твердых горючих веществ с воздухом может образовывать взрывоопасные смеси (например, серная пыль);
4) трудногорючие — вещества, способные горсть только под действием источника зажигания (например, в условиях пожара); но не способные к самостоятельному горению после его удаления: бромистый метил, аммиак водный технический, хлоренфенолят меди, дихлоральмочевина и др. Многие из них при смешивании с веществами первой группы способны интенсивно гореть и при определенных условиях взрываться;
5) негорючие — вещества, не способные к горению. К этой группе относятся хлористый калий, сульфат калия, сульфат аммония, суперфосфат и др. При смешивании их с веществами (окислителями) первой группы образуются смеси, склонные при определенных условиях к разогреванию и саморазложению, чувствительные к удару, трению и нагреву. Такая смесь при контактировании с веществами второй, третьей и четвертой групп может привести к их самовозгоранию.
Пестициды
Для защиты растений от вредителей, болезней и сорняков в сельском хозяйстве применяют агрохимические, биологические и химические методы.
По химическому составу различают следующие виды пестицидов: фосфорорганические, хлорорганические, мышьяксодержащие соедиения, препараты, содержащие органические соединения ртути, нитрофенольные соединения, производные синильной кислоты (цианиды), карбаматы (производные карбаминовой кислоты), препараты меди, серы, фтора (фториды), алкалоидные препараты и др.
Пестициды поступают в сельское хозяйство в различном агрегатном состоянии: в газообразном (например, бромметил), в жидком или растворенном (сероуглерод, дихлорэтан, хлор ИФК), а также в твердом (гранулированном или порошкообразном).
Большинство пестицидов являются веществами токсичными. Яд в человеческий организм может проникать через дыхательные пути, желудочно-кишечный тракт, кожу, даже неповрежденную. Всасывание через кожу усиливается при интенсивном потоотделении.
Подавляющее большинство пестицидов являются горючими веществами, загорающимися от кратковременно или длительно действующего источника зажигания. Процесс горения пестицидов сопровождается выделением большого количества ядовитых продуктов горения: хлористого водорода НС1, цианистого водорода НСN, оксида углерода СО, оксидов азота N0, NО2 и др. При неполном горении количество выделяющихся ядовитых газов и паров увеличивается. Горение пестицидов сопровождается значительным выделением тепла. Теплота сгорания их в среднем составляет 12600—15000 кДж/кг. Температура горения в условиях пожара может достигать 1500°С. Температура воспламенения многих горючих пестицидов выше 300 °С; исключение составляют сероуглерод и дихлорэтан, температура воспламенения которых значительно ниже. Температура самовоспламенения пестицидов в среднем выше 450 °С.
Некоторые пестициды, например динитроортокрезол и его соли, в условиях пожара при наличии детонатора могут взрываться. Многие из них склонны к самовозгоранию при контакте другими химическими веществами.
Обычно пестициды применяют в виде различных смесей (яд и наполнитель). Чем больше в них действующего вещества и меньше наполнителя, тем большую пожарную опасность они представляют. Например, действующее вещество препарата севин (нафтилкарбамат) представляет собой белое кристаллическое вещество; при наличии источника зажигания горит слегка зеленоватым пламенем. На его основе приготавливают смачивающиеся порошки (дусты), содержащие 50—58% действующего вещества.
На основе метафоса и других препаратов приготавливают минерально-масляные эмульсии, которые также горят. Интенсивность горения и выделяющееся при горении количество тепла зависит от вида и пожарной опасности минерального масла и количества действующего вещества в эмульсии.
Пожарная опасность растворов пестицидов в горючих растворителях зависит главным образом от вида и количества горючего растворителя. Пожарная опасность горючих пестицидов в воде или в водных эмульсиях значительно понижается. Эмульсии вспыхивают и горят только в условиях длительно действующего па них открытого пламени или других высокотемпературных источников зажигания.
Минеральные негорючие наполнители уменьшают горючесть, а следовательно, и пожарную опасность веществ. Для приготовления эмульсий и растворов пестицидов широко используют минеральные масла, дизельное топливо и другие легкие и тяжелые нефтепродукты. Например, дизельное топливо применяют для получения раствора гербицида 2,4-Д, веретенное масло — для приготовления минерально-масляной эмульсии хлориндана, концентрата полихлорпропилена (ПХП) и т. д.
Основными средствами тушения многих ядохимикатов является вода, высокократная воздушно-механическая и химическая пены, порошковые составы, песок и др.
Краткая характеристика наиболее пожароопасных пестицидов.
Динитроортокрезол[ДН, дипок, селинон, 2-метил-4,6-динитрокрезол] — кристаллическое вещество желтого цвета. Плохо растворим в воде. Хорошо растворяется в этиловом спирте. Легко воспламеняется и горит коптящим пламенем с большой скоростью. Динитроортокрезол и его соли взрывоопасны.
Для уменьшения взрывоопасности при приготовлении инсектицидных и гербицидных препаратов на основе динитроортокрезола в них вводят воду и различные добавки, удерживающие воду: сульфаты натрия и аммония,
мочевину.
На основе динитроортокрезола можно приготовить пастообразный препарат типа динок. Паста содержит около 50% динитроортокрезола (в виде аммонийной соли), 20—25% воды, а также добавки (сульфат натрия,
смачиватели). Пастообразные препараты динок после высыхания становятся взрывоопасными, поэтому следует предотвращать высыхание динитроортокрезольных паст подачей значительного количества воды. Динитроортокрезол и препараты на его основе ядовиты.
Дихлорэтан(этилен хлористый СН2С1СН2С1) — бесцветная, легковоспламеняющаяся жидкость с сильным запахом хлороформа, в воде труднорастворим, ядовит. Молекулярная масса 98,96, плотность 1253 кг/м3, температура кипения 73,7°С, температура плавления 96,7°С. Пары в 3,5 раза тяжелее воздуха; коэффициент диффузии пара в воздухе 0,077 см2/с. Температура вспышки 9°С; температура самовоспламенения 413°С, область воспламенения паров в воздухе 6,2—16 % (об.) или 250—640 г/м3; температурные пределы воспламенения насыщенных паров в воздухе: нижний 8, верхний 31 °С; теплота сгорания 11 196 кДж/кг. В воздухе горит коптящим пламенем; дымовые газы содержат токсичные пары. Тушить дихлорэтан следует тонкораспыленной водой или пеной, избегая при этом попадания дихлорэтана на резино-технические изделия (пожарные рукава, резиновые перчатки, обувь и т. п.), так как эти изделия быстро портятся.
Сероуглерод(СS2) — бесцветная, легковоспламеняющаяся, сильно ядовитая жидкость с неприятным запахом тухлой редьки. Молекулярная масса 76,14, температура плавления —112,1°С. При О °С коэффициент диффузии пара в воздухе 0,0883 см2/с; диэлектрическая проницаемость 2,625. Технический сероуглерод — желтая, непрозрачная жидкость, в воде почти не растворяется. Плотность 1263 кг/м3, температура кипения 46°С; плотность паров по воздуху 2,6; является диэлектриком, склонен к электризации. Температура вспышки —43°С, температура самовоспламенения 90°С, область воспламенения паров в воздухе 1—50% (об.), или 31 —1560 г/м3; температурные пределы воспламеняемости насыщенных паров в воздухе: нижний —50, верхний —26 °С, теплота сгорания 14070 кДж/кг.
При добавлении чстыреххлористого углерода к сероуглероду пожарная опасность последнего несколько уменьшается, но даже смесь из 20% (масс.) сероуглерода и 80% (масс.) четырсххлористого углерода (хлор-
смесь по ВТУБУ 50—54) имеет температурные пределы воспламенения: нижний —15, верхний 7°С. Температура самовоспламенения 151 °С.
Ортокрезол — бесцветная жидкость или кристаллы с сильным запахом фенола, растворяется в воде, плотность 1046,5 кг/м3, температура плавления 30,3°С. При нагревании выше температуры плавления смешивается со спиртом и эфиром. Температура вспышки 91°С, температура самовоспламенения 480°С, теплота сгорания 34200 кДж/кг.
Препарат 2,4-Д(натриевая соль 2,4-дихлорфеноксиуксусной кислоты) — горючий кристаллический порошок серого цвета, хорошо растворяется в воде. Температура плавления 215—218°С. Температура вспышки 273°С,
температура воспламенения 362°С, температура самовоспламенения 651 °С. Взвешенная в воздухе пыль не взрывоопасна до концентрации 500 г/м3.
Удобрения
В сельском хозяйстве применяют несколько десятков различных видов минеральных и других удобрений. Все минеральные удобрения классифицируют на:
азотные — аммиачная селитра NН4NОз, аммиачная вода
NН4ОН, мочевина (NН2)2СО и др.;
фосфорные — суперфосфат Са(Н2РО4)2·Н20, трикальцийфосфат Са3(Р04)2, фосфоритная мука и др.;
калийные — калий хлористый КС1, калиевая селитра КNО3 и др.
Применяют также комбинированные удобрения — тукосмеси, аммиачная селитра + суперфосфат, сульфат аммония + суперфосфат, биоминеральные удобрения и др.
Из перечисленных видов минеральных удобрений рассмотрим лишь те, которые представляют пожарную опасность: селитры, амми-
ачную воду, мочевину.
Аммиачная селитра(NН4NО3) — бесцветное кристаллическое вещество, содержащее 60 % кислорода, 5 % водорода и 35 % азота, причем половина азота находится в виде азота аммиака, а половина — в виде азота азотной кислоты. Селитра хорошо растворяется в воде, является сильным окислителем. В интервале температур 145 — 166°С аммиачная селитра плавится, при нагревании выше 300 °С взрывается. Разложение протекает по следующим уравнениям:
2NН4NО3 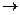 2N2 + О2 + 4H2O
2N2 + О2 + 4H2O
4NН4NО3 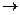 3N2 + 2NО2 + 8H2O
3N2 + 2NО2 + 8H2O
3NН4NО3 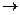 2N2 + N2О3 + 6H2O
2N2 + N2О3 + 6H2O
5NН4NО3 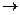 2HNO2 + 4N2 + 9H2O
2HNO2 + 4N2 + 9H2O
Взрывчатые свойства селитры увеличиваются при смешивании ее с органическими веществами и материалами (соломой, древесными опилками стружкой, щепками, жмыхом подсолнечника и т. п.). При повышении тем-
пературы селитра разлагается с выделением кислорода, который увеличивает интенсивность и распространенность пламени. Но даже без добавки горючих примесей аммиачная селитра способна к детонации. Это подтверждается примерами взрывов, происшедших в разных странах мира при попытке разрыхления селитры.
Скорость детонации селитры колеблется от 1500 до 3000 м/с. Объем выделяющихся газов при взрыве составляет 976 л/кг, теплота взрыва 1470 кДж/кг, температура взрыва 1230°С. При влажности выше 2,5% детонационные свойства селитры пропадают. К удару аммиачная селитра нечувствительна, взрывается только при достижении так называемой критической массы.
При обычных температурах хранения и транспортирования внутри массы чистой аммиачной селитры не происходит самовозгорания и, следовательно, термическое разложение ее исключается. В присутствии некоторых веществ как органического, так и неорганического происхождения температура разложения аммиачной селитры значительно снижается. Так, температура разложения аммиачной селитры при добавлении древесной муки составляет 170 °С, серного колчедана 120 °С, а при смешении ее с измельченным цементом (в соотношении 1:1) температура разложения аммиачной селитры понижается до 40 °С вследствие химической реакции между селитрой и гидрооксидом кальция.
Органические вещества при контакте с аммиачной селитрой также изменяют свои пожароопасные свойства.
Смеси аммиачной_селитры с горючими материалами (деревом, соломой, торфом, льном, мешкотарой и др.) склонны к тепловому самовозгоранию, что обусловлено экзотермической реакцией нитрования. За счет теплоты
реакции нитрования при температуре около 100°С начинается автокаталитическое разложение аммиачной селитры, в результате которого органические продукты разогреваются до температуры их самовоспламенения. Автокатализ вызывается главным образом выделяющимися при разложении аммиачной селитры диоксидом азота и в меньшей степени водяным паром. Особенно повышают пожаро- и взрывоопасность аммиачной селитры примеси порошкообразных металлов, которые могут служить сильнейшими катализаторами ее экзотермического разложения.
Калиевая селитра(КNО3) в чистом виде — бесцветное кристаллическое вещество; температура плавления 337°С; при нагревании разлагается
2КNО3 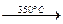 К2О + 2NО2 + О
К2О + 2NО2 + О
4КNО3 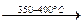 2К2О + 2N2 + 5О2
2К2О + 2N2 + 5О2
При разложении селитры выделяется атомный кислород, вследствие чего она и является сильным окислителем. Калиевая селитра более чувствительна к удару и трению, чем аммиачная. Пожарная опасность калиевой селитры может быть оценена хотя бы по тому показателю, что ее применяют для изготовления порохов и быстрогорящих пиротехнических составов. Способность к взрыву калиевой селитры увеличивается при смешении ее с органическими веществами.
На складах селитр возникший пожар распространяется с большой скоростью, что обусловлено выделением кислорода при разложении солей. Не рекомендуется приближаться вплотную к очагу горения, так как в результате выгорания селитры в массе ее могут образовываться пустоты, заполняемые водой. При нагревании вода превращается в пар, выделение которого аналогично взрыву.
Аммиак жидкийсинтетический и аммиак водный технический (аммиачная вода). Аммиак в почве под воздействием жизнедеятельности различных бактерий способствует образованию селитр.
Аммиак жидкий синтетический представляет собой бесцветную жидкость, хорошо растворимую в воде. Температура кипения 33,4°С, теплота испарения 1373 кДж/кг. Жидкий аммиак имеет температуру самовоспламенения 650°С. На воздухе он интенсивно испаряется, образуя с воздухом взрывоопасные смеси. Область воспламенения 15—28% (об.). Давление при взрыве достигает 0,6 МПа. Горит бледно-желтым пламенем. Теплота горения 18690 кДж/кг. При взаимодействии жидкого аммиака с иодом или хлором образуется йодистый или хлористый азот — сильные взрывчатые вещества.
Аммиак водный технический (аммиачная вода) — бесцветная или желтая жидкость с резким запахом аммиака. Представляет собой раствор газообразного аммиака в воде. В растворе его содержится 20—25%, труд-
ногорюч. Однако при нагревании аммиак легко испаряется и образует с воздухом в закрытом объеме взрывоопасные смеси. Температура вспышки 23°С при 25%-ной концентрации аммиака. Температурные пределы воспла-
менения 23—33°С, температура самовоспламенения выше 750 °С. Аммиак образует взрывоопасные смеси с кислородом воздуха и оксидом азота N2О. Области воспламенения: в кислороде 13,5—79%, в оксиде азота N2О
2,2—72%.
Мочевина(карбамид) — диамид угольной кислоты выпускается в виде кристаллов или гранул и относится к азотным удобрениям. В техническом продукте содержится до 0,015% свободного аммиака и до
1% биурета. Биурет — амид аллофановой кислоты, или уреидоформамид. При нагревании его до 160°С выделяется аммиак и получается циануро-
вая кислота.
Mочевина имеет температуру вспышки 182°С, температуру воспламенения 233°С, температуру самовоспламенения 610°С. Дым при горении карбамида содержит токсичные пары. Взвешенная в воздухе пыль карбамида не взрывоопасна. При взаимодействии карбамида с азотной кислотой может образоваться взрывчатый нитрат мочевины.
При длительном хранении навалом в жаркое время года карбамид слеживается и частично разлагается с образованием биурета и аммиака. Это особенно необходимо учитывать в районах с жарким климатом.
В настоящее время все большее распространение получают бактериальные удобрения и их смеси с минеральными удобрениями.
Биоминеральные удобрения — это продукт переработки торфа, бурого угля, лигнина, сланцев бактериями. Химический состав биоминеральных удобрений может быть различным. Наиболее распространенным является следующий состав биоминеральных удобрений: 79% торфа, 5%
каинита, 5% фосфата шлака, 4% известняка, 2% аммиака водного, 3% барды паточной и 2% микробной закваски. Таким образом, биоминеральные удобрения относятся к органо-мннералыто-бактериальным удобрениям. Почти все исходные продукты удобрений являются горючими материалами. Процесс приготовления биоминеральных удобрений является наиболее пожароопасным.
