Металлорганические соединения
Металлорганическими соединениями называются вещества, в молекулах которых атомы металла непосредственно связаны с атомами углерода. Общая формула металлорганических соединений имеет вид R—Ме, где R — углеводородный радикал, Ме — одновалентный металл.
Например, С2Н5Nа — этилнатрий. Здесь радикал этила С2Н5 — непосредственно связан с атомом натрия. Но этилат натрия С2Н5ОNа не является металлорганическим соединением, так как натрий соединяется с радикалом через атом кислорода.
Металлорганические соединения в последнее десятилетие находят все большее применение в народном хозяйстве. Их широко используют в органическом синтезе как вещества с высокой химической активностью. Они используются так же как катализаторы для получения различных полимеров. Их добавляют в моторные топлива как антидетонаторы.
Все металлорганические соединения являются горючими веществами. Они могут находится как в твердом, так и в жидком состоянии. Металлорганические соединения щелочных металлов (лития, натрия, калия, рубидия) представляют собой твердые порошкообразные или кристаллические вещества.
Металлорганические соединения, в молекулах которых содержатся атомы галогенов (хлора, фтора, брома, иода), называются смешанными металлорганическими соединениями. Они, как правило, менее пожароопасны, чем соответствующие им алкильные и арильные производные.
Оловоорганические соединения широко применяют как стабилизаторы полимеров. Органические соединения щелочных металлов позволяют осуществить синтезы витаминов и антибиотиков. Из металлорганических соединений получают металлы сверхвысокой чистоты.
Металл органические соединения классифицируются на 4 группы:
1) металлорганические соединения легких металлов; Nа, К, Са, Мg, Al и др. Эти соединения, устойчивые в атмосфере инертных газов, имеют наибольшее практическое значение;
2) металлорганические соединения средних металлов: Сd, Zn, Sb, Sn, As и др. Многие из них менее устойчивы, чем соединения первой группы;
3) металлорганические соединения тяжелых металлов (свинца, ртути, золота, меди и т. д.);
4) комплексные металлорганические соединения.
Металлорганические соединения легких и средних металлов получают взаимодействием металла с галоидными алкилами
СН3С1 + 2Na 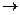 СH3 Na +NaС1 + Q
СH3 Na +NaС1 + Q
Реакция протекает в растворителе, в котором легко растворяются образующиеся металлорганические соединения.
Металлорганические соединения легких металлов и отдельные соединения средних металлов являются пирофорами, так как имеют температуру самовоспламенения ниже 0°С. Например, метилнатрий (СН3Nа) имеет температуру самовоспламенения ниже—100 °С; триэтилалюминий (С2Н5)3А1 самовоспламеняется при —68 oС, диэтилалюминийхлорид (С2Н5)2АlCl — при — 60 °С. На воздухе эти соединения самовозгораются, с водой взаимодействуют бурно со взрывом; загораются в атмосфере углекислого и сернистого газов.
Реакционная способность металлорганических соединений сильно зависит от активности металла. Она велика у щелочных металлов и сравнительно мала для соединений ртути, свинца, меди. Кроме того, реакционная способность зависит от числа атомов углерода в радикале.
Чем больше число атомов углерода в радикале, тем меньше реакционная способность соединения.
Органические соединения щелочных металлов на воздухе самовоспламеняются со взрывом:
С2Н5Na + 3,5 O2 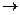 2CO2 +2,5 H2O + 0,5Na2O + Q
2CO2 +2,5 H2O + 0,5Na2O + Q
Металлорганические соединения алюминия, магния,
цинка самовоспламеняются спокойно.
Взаимодействие органических соединений легких металлов и некоторых средних с водой протекает со взрывом. Например
(C2H5)Na + H2O 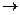 NaOH + C2H6 + Q
NaOH + C2H6 + Q
(C2H5)2Zn + 2 H2O 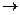 Zn(OH)2 + C4H10 + Q
Zn(OH)2 + C4H10 + Q
Эти реакции сопровождаются выделением гидроксида металла и предельного углеводорода. Реакции являются экзотермичными. Аналогично протекает реакция взаимодействия этих соединений с кислотами. Например
С2Н5Na + HCl 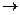 NaCl + C2H6 + Q
NaCl + C2H6 + Q
В результате реакции образуется соответствующая соль металла и предельный углеводород. Если эта реакция для органических соединений легких металлов протекает со взрывом, то для соединений тяжелых металлов она протекает спокойно. Органические соединения тяжелых
металлов устойчивы на воздухе, но со временем они медленно oкисляются и разлагаются, особенно под действием света.
Металлорганические соединения устойчивы в атмосфере азота или водорода и при нагревании до определенной температуры, а затем разлагаются. Органические соединения щелочных металлов при термическом распаде разлагаются на гидрид металла и непредельный углеводород. Все другие органические соединения средних и тяжелых металлов — на металл и предельный углеводород.
Многие металлорганические соединения легких и средних металлов (натрия, бериллия, алюминия, магния и т. д.) самовозгораются в атмосфере углекислого газа, хлористого водорода, накаляются до свечения в атмосфере сернистого газа.
В связи с высокой химической активностью органические соединения легких и средних металлов получают и применяют в атмосфере азота или водорода.
Особое положение в ряду металлорганических соединений занимают ацетилениды и карбиды. Эти соединения устойчивы на воздухе, но при трении, ударе, нагревании до 120 — 200 °С они взрываются. Карбиды щелочных металлов бурно со взрывом взаимодействуют с водой. Ацетиленид натрия С2Nа2 — белый порошок, нерастворимый в растворителях. Кислород и сухой воздух на него не действуют. При нагреве на воздухе превращается в Nа2СО3, разогреваясь до свечения; взаимодействует энергично с сухим хлором с выделением светящейся сажи и NаС1. В парах брома реакция идет со взрывом. С водой ацетиленид натрия взаимодействует со взрывом
С2Na2 +2H2O 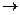 2 NaOH + 2C + H2
2 NaOH + 2C + H2
Широкое применение в синтезе высокомолекулярных соединений нашли алюминийорганические соединения. Это — пирофорные жидкости, самовоспламеняющиеся на воздухе. Они легко взаимодействуют с эфиром, образуя комплексные соединения — эфираты алюминийалкилов.
Эти эфираты бесцветные, легкоподвижныс жидкости, на воздухе сильно дымят и самовозгораются. Взаимодействие с водой сопровождается взрывом. При разбавлении бензолом активность эфиратов понижается.
Алюминийгалоидалкилы, например (С3Н5)2AlCl — это жидкости от коричневого до темно-коричневого цвета, разлагающиеся при температуре выше 130°С с выделением свободного галогена. На воздухе дымят и самовозгораются. Со взрывом взаимодействуют с водой. Комплексные металлорганические соединения тяжелых металлов характеризуются сравнительно малой стойкостью. На свету и особенно при нагревании до определенной температуры разлагаются со взрывом. Например, золотобромдиэтилпиридин взрывается при нагревании до 79 °С.
Металлорганические соединения тяжелых металлов (ртути, свинца и т. д.) представляют собой жидкости, устойчивые к действию воздуха и воды. Многие из них сильно летучи. Как правило, все они чрезвычайно ядо-
виты. По степени пожарной опасности характеризуются как ЛВЖ или ГЖ (в зависимости от молекулярной массы углеводороного радикала). Например, диэтилртуть (С3Н5)2Hg, бесцветная, легкоподвижная, летучая, чрезвычайно ядовитая жидкость с температурой кипения 159°С и температурой вспышки 18°С.
Особую группу образуют соединения железа, кобальта, никеля с оксидом углерода. Эти соединения называются карбонилами: Fе(СО)5— пeнтакарбонил железа, Со(СО)4 — тетракарбонил кобальта, Ni(СО)4 — тетракарбонил никеля, Fе(СО)4Н2 — карбонилгидрид железа; Fе(СО)5 — пентакарбонил железа — это прозрачная жидкость (на свету желтеет), не ядовита, плавится при 20 °С, кипит при 108°С, теплота образования 209
кДж/моль; теплота горения 16100 кДж/моль. Получается нагреванием железа в струе оксида углерода при 150—200°С и давлении 10 МПа. На воздухе при нагревании до 140°С пентакарбонил железа разлагается на Fе и СО. В воде не растворим, но растворим в органических
растворителях. Применяется при получении кубовых красителей и сверхчистого желeза.
Fе(СО)4Н2 — карбонилгидрид железа — желтоватая жидкость с отвратительным запахом. На воздухе самовозгорается со взрывом. Таким образом, наиболее пожароопасными являются металлорганическиe соединения легких и средних металлов. Эффективного средства тушения этих соединений нет. Наибольший эффект дает тушение их составами СИ-2 и СИ-ВК. Можно применять также хлористый натрий, но он менее эффективен. Ни в коем случае не допускается применять воду, пену, диоксид углерода для тушения металлорганических соединений I и II групп.
Металлорганические соединения тяжелых металлов тушат также, как обычные ЛВЖ или ГЖ.
