Диффузионное и кинетическое горение
Горючие системы могут быть химически однородными и неоднородными. К химически однородным относятся системы, в которых горючее вещество и воздух равномерно перемешаны (смеси горючих газов, паров или пылей с воздухом). К химически неоднородным относятся системы, в которых горючее вещество и воздух не перемешаны и имеют поверхности раздела: твердые горючие материалы и жидкости, находящиеся в воздухе, струи горючих газов и паров, поступающие в воздух, и т. д.
Примером горения паров и газов (гомогенное горение) является горение паров, поднимающихся со свободной поверхности жидкости, или горение газа, выходящего из трубы. Так как парциальное давление кислорода воздуха равно 21,2 кПа, а в зоне горения давление равно нулю, кислород из воздуха диффундирует через слой продуктов сгорания к зоне горения. Следовательно, скорость реакции горения зависит от скорости диффузии кислорода.
Примером горения на поверхности твердого вещества (гетерогенное горение) является горение антрацита, кокса, древесного угля. В этом случае диффузии кислорода к зоне горения также препятствуют продукты сгорания, что видно из схемы. Концентрация кислорода в объеме воздуха (С1) значительно больше концентрации его вблизи зоны горения (Со). В отсутствие достаточного количества кислорода в зоне горения химическая реакция горения тормозится.
Таким образом, полное время сгорания химически неоднородной горючей системы складывается из времени, необходимого для возникновения физического контакта между горючим веществом и кислородом воздуха 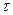 ф, и
ф, и
времени, затрачиваемого на протекание самой химической реакции 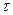 х
х
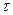 г=
г= 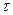 ф+
ф+ 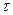 х
х
В случае гомогенного горения величина 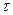 ф называется временем смесеобразования, а в случае гетерогенного горения — временем транспортировки кислорода из воздуха к твердой поверхности горения.
ф называется временем смесеобразования, а в случае гетерогенного горения — временем транспортировки кислорода из воздуха к твердой поверхности горения.
В зависимости от соотношения 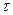 ф и
ф и 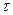 х горение называют диффузионным или кинетическим. При горении химически неоднородных горючих систем время диффузии кислорода к горючему веществу несоизмеримо больше времени, необходимого для протекания химической реакции, т. е.
х горение называют диффузионным или кинетическим. При горении химически неоднородных горючих систем время диффузии кислорода к горючему веществу несоизмеримо больше времени, необходимого для протекания химической реакции, т. е. 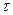 ф>>
ф>> 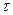 х, и практически
х, и практически 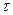 ф
ф 
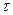 х,. Это значит, что скорость горения определяется скоростью диффузии кислорода к горючему веществу. В этом случае говорят, что процесс протекает в диффузионной области. Такое горение и называется диффузионным. Все пожары представляют собой диффузионное горение.
х,. Это значит, что скорость горения определяется скоростью диффузии кислорода к горючему веществу. В этом случае говорят, что процесс протекает в диффузионной области. Такое горение и называется диффузионным. Все пожары представляют собой диффузионное горение.
Если время физической стадии процесса оказывается несоизмеримо меньше времени, необходимого для протекания химической реакции, т. е. 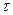 г<<
г<< 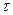 х, то можно принять
х, то можно принять 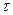 г
г 
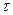 х. Скорость процесса практически определяется только скоростью химической реакции. Такое горение называется кинетическим. Так горят химически однородные горючие системы, в которых молекулы кислорода хорошо перемешаны с молекулами горючего вещества, и не затрачивается время на смесеобразование. Так как скорость химической реакции при высокой температуре велика, горение таких смесей происходит мгновенно и носит характер взрыва.
х. Скорость процесса практически определяется только скоростью химической реакции. Такое горение называется кинетическим. Так горят химически однородные горючие системы, в которых молекулы кислорода хорошо перемешаны с молекулами горючего вещества, и не затрачивается время на смесеобразование. Так как скорость химической реакции при высокой температуре велика, горение таких смесей происходит мгновенно и носит характер взрыва.
Диффузионное пламя
Пространство, в котором сгорают пары и газы, называется пламенем или факелом. Пламя может быть кинетическим или диффузионным в зависимости от того, горит ли заранее подготовленная смесь паров или газов с воздухом или такая смесь образуется в пламени в процессе горения. В условиях пожара газы, жидкости и твердые вещества горят диффузионным пламенем.
Структура диффузионного пламени существенно зависит от сечения потока горючих паров и газов и его скорости. По характеру потока различают ламинарное и турбулентное диффузионное пламя. Ламинарное пламя возникает при малых сечениях потока паров или газов, движущихся с небольшой скоростью (пламя свечи, спички, газа в горелке небольшого диаметра и т.д.). При пожарах образуется турбулентное пламя. Оно меньше изучено, и для объяснения этого явления используют положения теории ламинарного пламени.
Пламя состоит из зоны горения и зоны паров, последняя
занимает почти весь объем пламени. Подобное по строению пламя образуется также при горении газов и твердых веществ, если скорость движения газов и паров соответствует ламинарному режиму.
Зона горения в диффузионном пламени представляет собой очень тонкий слой, в котором протекает реакция горения. Превращение веществ и выделение тепла в этом слое вызывают возникновение молекулярной диффузии в прилегающих к нему слоях воздуха и горючего. Причиной молекулярной диффузии является разность парциальных давлений и температур газов, участвующих в горении.
Распределение концентраций газов и паров в ламинарном диффузионном пламени и окружающей его среде отражает процессы диффузии, происходящие в пламени. Образующиеся
в зоне горения продукты сгорания диффундируют как в воздух, так и в горючие пары и газы. В пламени малого размера продукты сгорания находятся во всем объеме зоны паров и газов, а в пламени большого размера только в слое, прилегающем к зоне горения. Концентрация кислорода в зоне горения равна нулю, так как он полностью вступает в реакцию. Вследствие
этого кислород в зону паров диффундировать не может, и горение в ней отсутствует.
Турбулентное пламя отличается от ламинарного тем, что не имеет четких очертаний и постоянного положения фронта пламени. Температура его при горении нефтепродуктов составляет: 1200 °С для бензина, 1100 °С для керосина тракторного, дизельного топлива, сырой нефти и 1000 °С для мазута. При горении древесины в штабелях температура турбулентного пламени составляет 1200—1300 °С.
Расход воздуха на горение
Минимальное количество воздуха, необходимого для полного сгорания единицы массы (кг) или объема (м3) горючего вещества, называется теоретически необходимым и обозначается Vов.
Горючее вещество — индивидуальное химическое соединение.
Для таких горючих веществ независимо от их агрегатного состояния теоретически необходимое количество воздуха определяется из уравнений реакции горения. На m кмоль горючего вещества приходится п кмоль кислорода и азота из уравнения реакции горения. Обозначив массу (в кг) горючего вещества, численно равную молекулярной массе его, через М, составляют пропорцию
тМ кг— п 22,4 м3
1 кг — Vов м3,
где 22,4 — объем 1 кмоль газов (при О °С и 101325 Па).
Теоретически необходимый объем воздуха для сгорания 1 кг вещества равен (из пропорции)
Vов =  (1),
(1),
Если объем воздуха, полученный по формуле (1), необходимо привести к иным условиям, то пользуются формулой
Vв =  (2)
(2)
где Т — заданная температура газов, К;
р — заданное давление, Па.
Теоретически необходимый объем воздуха для сгорания 1 м3 горючих газов определяется по формуле
Vов=  (3)
(3)
Горючее вещество — сложная смесь химических соединений.
Такими веществами являются древесина, торф, каменный уголь и др. Для определения теоретически необходимого объема воздуха нужно знать элементный состав горючего вещества, выраженный в массовых процентах, т. е. содержание С, Н, О, S, N, золы (А), влаги (W). Элементный состав вещества определяют в аналитической лаборатории. Чтобы рассчитать Vов, запишем уравнение реакции горения углерода, водорода и серы и массовое соотношение реагирующих веществ
С + О2 = СО2 2Н2 + О2 = 2Н2О S + О2 = SО2
12 + 32 = 44 4 + 32 = 36 32 + 32 = 64
Если для сгорания 12 кг углерода требуется 32 кг кислорода, то для 0,01 кг углерода, т. е. 1% (масс.) его потребуется кислорода 0,01·32/12 = 0,01 · 8/3 кг, для водорода соответственно потребуется 0,01·32/4 = 0,01· 8 кг и для серы 0,01· 32/32 = 0,01 · 1 кг кислорода.
Для полного сгорания 1 кг горючего вещества потребуется кислорода (в кг)
 [С] + 8· 0,01 [Н] + 0,01 [S] — 0,01 [О]
[С] + 8· 0,01 [Н] + 0,01 [S] — 0,01 [О]
где [С], [Н], [S], [О] — содержание углерода, водорода, серы в кислорода в горючем веществе, % (масс.).
На вычисленное количество кислорода в воздухе приходится в 77/23 раза больше азота. Сумма азота и кислорода составляет массу воздуха Loв (в кг), необходимую для горения 1 кг вещества
Loв = 

После преобразования получим
Loв = 0,3478  (4)
(4)
Чтобы выразить количество воздуха в объемных единицах, нужно правую часть выражения (4) разделить на массу 1 м3 воздуха при нормальных условиях, т. е. на 1,293 кг/м3. В результате получим
Vов = 0,269  (5)
(5)
Горючее вещество — смесь газов.
К этой группе веществ относятся горючие газы, например природный, доменный, коксовый и др. Все они в том или ином количестве содержат СО, СН4, Н2, Н2S, С2Н4 и др. Состав горючих газов обычно выражают в объемных процентах. Для вывода формулы расчета Vов напишем уравнение
реакции горения наиболее распространенных газов:
СН4 + 2О2 = С02 + 2Н2О Н2S + 1,5О2 = Н2О + S02
2СО + 02 = 2СО2 2Н2 + О2 = 2Н2О
Если для сгорания 1 м3 метана требуется 2 м3 кислорода, как это видно из уравнения, то для сгорания 0,01 м3 метана, т. е. 1% (об.) потребуется 0,01·2 м3 кислорода. Для сгорания 1 м3 оксида углерода потребуется 0,01/2 м3 кислорода, такое же количество кислорода потребуется для сгорания 1 м3 водорода, а для сгорания сероводорода необходимо 0,01·1,5 м3 кислорода.
Для полного сгорания 1 м3 горючего газа потребуется кислорода (в м3)
0,01·2[СН4] + 
где [СН4], [Н2], [СО], [Н2S] и [02] — содержание метана, водорода,
оксида углерода, сероводорода и кислорода, % (об.).
В воздухе на этот объем кислорода приходится в 79/21 раза больше азота. Сумма азота и кислорода составляет объем (м3) воздуха, необходимый для сгорания 1 м3 газа
Vов = 
После преобразования получим
Vов =  (6)
(6)
Как видно из уравнения (6), числа в его числителе есть коэффициенты при кислороде в уравнениях реакций горения. Поэтому если в составе газа будут другие горючие компоненты, они могут быть поставлены в уравнение (6) с коэффициентами, взятыми из их уравнений горения.
Практически при горении во время пожара расходуется воздуха значительно больше теоретически необходимого. Разность между количеством воздуха, практически расходуемым на горение, и теоретически необходимым, называется избытком воздуха. Отношение же количества воздуха, практически расходуемого на горение (Vв.пр), к теоретически необходимому называется коэффициентом избытка воздуха и обозначается
 (7)
(7)
Учитывая, что концентрация кислорода в воздухе составляет 21 % (об.), а процентное содержание свободного кислорода в продуктах сгорания определится из анализа, можно легко найти коэффициент избытка
воздуха

 (8)
(8)
Продукты сгорания. Дым
Продуктами сгорания называют газообразные, жидкие и твердые вещества, образующиеся в результате соединения горючего вещества с кислородом в процессе горения. Состав их зависит от состава горящего вещества и условий его горения. При горении их в достаточном количестве воздуха и при высокой температуре образуются продукты полного сгорания: СО2, Н20, N2. При горении в недостаточном количестве воздуха или при низкой температуре кроме продуктов полного сгорания образуются продукты неполного сгорания: СО, С (сажа).
Продуктами сгорания - неорганические вещества, такие как сера, фосфор, натрий, калий, кальций, алюминий, титан, магний и др.
в большинстве случаев являются твердые вещества, например Р2О5, Nа2О2, СаО, МgО, Образуются они в дисперсном состоянии, поэтому поднимаются в воздух в виде плотного дыма. Продукты сгорания алюминия, титана и других металлов в процессе горения находятся в расплавленном состоянии.
Дым представляет собой дисперсную систему, состоящую из мельчайших твердых частиц, взвешенных в смеси продуктов сгорания с воздухом. Диаметр частиц дыма колеблется от 1 до 0,01 мкм.
В составе дыма содержатся продукты термоокислительного разложения горючих веществ. Образуются они при нагреве еще негорящих горючих веществ, находящихся в среде воздуха или дыма, содержащего кислород.
Продукты неполного сгорания и термоокислительного разложения, в большинстве случаев являются токсичными веществами, поэтому тушение пожаров в помещениях производят только в кислородных изолирующих противогазах.
Горючее вещество — индивидуальное химическое соединение.
В этом случае расчет ведут, исходя из уравнения реакции горения. Объем влажных продуктов сгорания единицы массы (кг) горючего вещества при нормальных условиях рассчитывают по формуле
Vп..с. =  (9)
(9)
где Vп..с. — объем влажных продуктов сгорания, м3/кг; mсо2, mн2о, mN2, mгор — число киломолей диоксида углерода, паров воды, азота и горючего вещества в уравнении реакции горения; М — масса горючего вещества, численно равная молекулярной массе, кг.
Горючее вещество — сложная смесь химических соединений.
Если известен элементный состав сложного горючего вещества, то состав и количество продуктов сгорания 1 кг вещества можно определить по уравнению реакции горения отдельных элементов. Для этого
составляют уравнения реакции горения углерода, водорода, серы и определяют объем продуктов сгорания, приходящийся на 1 кг горючего вещества. Уравнение реакции горения углерода имеет вид
С + О2 + 3,76 = СО2 + 3,76 N2
При сгорании 1 кг углерода получается 22,4/12=1,86 м3
СО2 и 22,4 ·3,76/12 = 7,0 м3 N2.
При горении углерода, водорода и серы кислород поступает из воздуха. Однако в состав горючего вещества может входить кислород, который также принимает участие в горении. В этом случае воздуха на горение вещества расходуется соответственно меньше.
В составе горючего вещества могут находиться азот и влага, которые в процессе горения переходят в продукты сгорания. Для учета их необходимо знать объем 1 кг азота и паров воды при нормальных условиях. Объем 1 кг азота равен 0,8 м3, а паров воды 1,24 м3.
В воздухе при 0°С и давлении 101325 Па на 1 кг кислорода приходится 3,76 ·22,4/32 = 2,63 м3 азота.
На основании приведенных данных определяют состав и объем продуктов сгорания 1 кг горючего вещества
Горючее вещество — смесь газов.
Количество и состав продуктов сгорания для смеси газов определяют по уравнению реакции горения компонентов, составляющих
смесь. Затем определяют состав и количество продуктов сгорания смеси газов.
Анализ продуктов сгорания, взятых на пожарах в различных помещениях, показывает, что в них всегда содержится значительное количество кислорода. Если пожар возникает в помещении с закрытыми оконными, дверными или другими проемами, то пожар при наличии горючего может продолжаться до тех пор, пока содержание кислорода в смеси воздуха с продуктами сгорания в помещении не снизится до 14—16% (об.). Следовательно, на пожарах в закрытых помещениях содержание кислорода в продуктах сгорания может быть в пределах от 21 до 14% (об.).
По содержанию кислорода в продуктах сгорания на пожарах можно судить о коэффициенте избытка воздуха, при котором происходило горение.
Теплота сгорания
Реакции, сопровождающиеся поглощением тепла, а также образующиеся при этом соединения называются эндотермическими. Без нагревания извне эндотермическая реакция прекращается.
Реакции, сопровождающиеся выделением тепла, а также образующиеся при этом соединения называются экзотермическими. Все реакции горения относятся к экзотермическим. Вследствие выделения тепла они, возникнув в одной точке, способны распространяться на всю массу реагирующих веществ.
Закон Гесса состоит в следующем: тепловой эффект химического превращения не зависит от пути, по которому реакция протекает, а зависит лишь от начального и конечного состояний системы при условии, что тем- пература и давление (или объем) в начале и конце реакции одинаковы.
Метан можно получить из 1 моль углерода и 2 моль водорода. При сжигании метана получаются 2 моль воды и 1 моль диоксида углерода
С + 2Н2 = СН4 + 74,8 кДж (Q)
СН4 + 2О2 = СО2 + 2Н2О + Qгор
Те же продукты образуются при сгорании водорода и углерода. При этих реакциях общее количество выделившегося тепла равно 963,5 кДж.
2Н2 + О2 = 2Н2О + 570,6 кДж
С+ О2 = СО2 + 392,9 кДж
963,5 кДж (Q)
Поскольку начальные и конечные продукты в обоих случаях одинаковы, их общие тепловые эффекты должны быть равны согласно закону Гесса, т. е.
Q1 + Qгор = Q
откуда
Qгор = Q - Q1
следовательно, теплота сгорания метана будет равна
Qгор = 963,5 — 74,8 = 888,7 кДж/моль
Таким образом, теплота сгорания химического соединения (или их смеси) равна разности между суммой теплот образования продуктов сгорания и теплотой образования сгоревшего химического соединения (или веществ, составляющих горючую смесь). Следовательно, для определения теплоты сгорания химических соединений необходимо знать теплоту их образования и теплоту образования продуктов, получающихся после сгорания.
Теплоту сгорания экспериментально определяют в калориметрической бомбе и газовом калориметре. Различают высшую и низшую теплоты сгорания. Высшей теплотой сгорания Qв называют количество тепла, выделяемое при полном сгорании 1 кг или 1 м3 горючего вещества при условии, что содержащийся в нем водород сгорает с образованием жидкой воды.
Низшей теплотой сгорания Qн называют количество тепла, выделяемое при полном сгорании 1 кг или 1 м3 горючего вещества при условии сгорания водорода до образования водяного пара и испарении влаги горючего вещества.
Высшую и низшую теплоты сгорания твердых и жидких горючих веществ можно определить по формулам Д. И. Менделеева
Qв = 339,4  + 1257
+ 1257  - 108,9
- 108,9  (12)
(12)
Qн = 339,4  + 1257
+ 1257  - 108,9
- 108,9  - 25,1(9
- 25,1(9  + W), (13)
+ W), (13)
где Qв, Qн — высшая и низшая теплота сгорания, кДж/кг; [С], [Н],
[О], [S], W— содержание в горючем веществе углерода, водорода,
кислорода, горючей серы и влаги, %.
Существует нижний предел теплоты сгорания, ниже которого вещества становятся не способными к горению в атмосфере воздуха. Эксперименты показывают, что вещества являются негорючими, если они не относятся к
взрывоопасным и если их низшая теплота сгорания в воздухе не превышает 2100 кДж/кг. Следовательно, теплота сгорания может служить для ориентировочной оценки горючести веществ. Однако следует отметить, что горючесть твердых веществ и материалов в значительной степени зависит и от их состояния. Так, лист бумаги, легко воспламеняющийся от пламени спички, будучи нанесенным на гладкую поверхность металлической плиты или бетонной стены, становится трудногорючим. Следовательно, горючесть веществ зависит также от скорости отвода тепла из зоны горения.
Если при горении образуется сажа, то, следовательно, горючее вещество выделяет тепла меньше того количества, которое указано в таблицах. Для веществ, богатых углеродом, коэффициент недожога  составляет 0,8 —0,9. Следовательно, на пожарах при горении 1 кг резины может выделиться не 33520 кДж, а только 33520•0,8 = 26816 кДж.
составляет 0,8 —0,9. Следовательно, на пожарах при горении 1 кг резины может выделиться не 33520 кДж, а только 33520•0,8 = 26816 кДж.
Размер пожара обычно характеризуется площадью пожара. Количество тепла, выделяющееся с единицы площади пожара в единицу времени, называется теплотой пожара Qп
Qп = Qн 
где vм— массовая скорость выгорания, кг/(м2·с).
Температура горения
Та температура, до которой в процессе горения нагреваются продукты сгорания, называется температурой горения. Различают калориметрическую, теоретическую и действительную температуры горения. Действительная температура горения для условий пожараназывается температурой пожара.
Под калориметрической температурой горения понимают ту температуру, до которой нагреваются продукты полного сгорания при следующих условиях:
I) все выделяющееся при горении тепло расходуется на нагрева-
ние продуктов сгорания (потери тепла равны нулю);
2) начальные температуры воздуха и горючего вещества
равны 0°С;
3) количество воздуха равно теоретически необходимому (  =1);
=1);
4)происходит полное сгорание.
Калориметрическая температура горения зависит только от состава горючего вещества и не зависит от его количества.
Для оценки условий пожара используют только калориметрическую тем-
пературу горения и температуру пожара. Различают температуру внутреннего и наружного пожара.
Температура внутреннего пожара — это средняя температура дыма в помещении, где происходит пожар.
Температура наружного пожара — температура пламени.
При расчете калориметрической температуры горения и температуры внутреннего пожара исходят из того, что низшая теплота сгорания Qн горючего вещества равна энергии qгнеобходимой для нагревания продуктов сгорания от 0°С до калориметрической температуры горения
Qн = qг
Величину qг назовем условно теплосодержанием продуктов сгорания
qг = С´pm·tг
где Vп.с. - объем продуктов сгорания, м3/кг; С´pm - средняя объем-
ная теплоемкость продуктов сгорания, кДж/(м3К); tг - температура горения, °С.
Поскольку продукты сгорания состоят из нескольких газообразных веществ, теплоемкость которых различна, суммарное теплосодержание их может быть выражено следующим образом:
qг =qRO2 + qН2О + qN2 = V RO2 С´СО2 tг + V Н2О С´Н2О tг + V N2 С´ N2 tг
гдеVRO2, VН2О, VN2 - объемы компонентов продуктов сгорания
(RО2=СО2+S02); С´СО2, С´Н2О, С´N2 — теплоемкость компонентов продуктов сгорания (теплоемкость СО2 принимается для смеси СО2
и S02).
Для определения tг рассчитывают теплосодержание продуктов сгорания при нескольких температурах и выбирают два значения, между которыми находится значение низшей теплоты сгорания вещества. Искомую температуру определяют затем интерполяцией.
Чтобы судить о характере изменения температуры при пожаре в зависимости от различных условий горения, введено понятие сред необъемной температуры пожара, под которой понимают среднее значение из величины
температур, измеренных термопарами в различных точках внутреннего пожара.
