Диаграммы зависимости. Мольные доли.
Мольные доли отдельных форм определяются значениями констант неустойчивости соответствующих ступеней равновесия и концентрацией свободного лиганда. Если известны константы неустойчивости, то , задавая концентрацию свободного лиганда ( либо водородный показатель, в частности), можно построить кривые распределения отдельных форм комплексов. Площадь под кривыми характеризует область существования определенного комплекса. Отрезок, проведенный параллельно оси абсцисс характеризует в точках пересечения с кривыми в диаграмме мольные доли каждого компонента.
В практической части будут представлены 4 диаграммы зависимости мольных долей от водородного показателя для каждого из рассматриваемых комплексов.
Определение рН раствора
Потенциометрическое определение рН раствора с помощью стеклянного электрода
Для измерения рН исследуемого раствора стеклянный электрод и электрод сравнения погружают сначала в буферный раствор с известным рНст ( рН-стандарт) и настраивают рН-метр на величину рН этого раствора. Затем электроды промывают и переносят в исследуемый раствор с рНx; при этом рНх = рНст + [(Еx - Eст)F/2,303RT], где Ех и Eст - соответствующие потенциалы стеклянного электрода. Для удобства шкалу рН-метра градуируют в единицах рН и снабжают специальным устройством для контроля температуры раствора (чтобы регулировать величину 2,303RT).
Для калибровки стеклянного электрода в качестве рН - стандартов рекомендованы: насыщенный раствор тартрата калия; 0,05 М раствор бифталата калия; смесь 0,05 М раствора КН2РО4 и 0,025 М раствора Na2HPO4, смесь 0,008695 М раствора КН2РО3 и 0,03043 М раствора Na2HPO4, 0,01 М раствор Na2B4O7. При 25 °С величины рН этих растворов соответственно равны: 3,56; 4,01; 6,87; 7,41; 9,18. Причем рН будет иметь одно и то же значение независимо от того, какой из рН-стандартов был взят при градуировке электрода.
Хотя измеренные рН - метром значения рН равны — lg(aHзO+)только для очень разбавленных водных растворов, тем не менее, эти величины служат полезной характеристикой кислотности растворов, в т.ч. и неводных. При замене воды неводным растворителем увеличивается электрическое сопротивление раствора, становится менее воспроизводимым потенциал электрода, поэтому рекомендуется рассматривать каждый растворитель как независимую систему с собственной шкалой кислотности, протяженность которой определяется величиной константы автопротолиза растворителя.
Схематически установка для определения pH раствора изображена на рисунке 1.
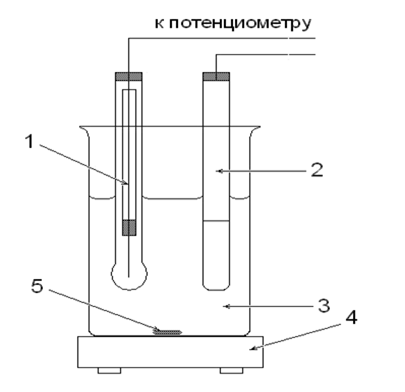
Рис. 1. Ячейка для определения рН раствора: 1 - Индикаторный стеклянный электрод, 2 ‑ насыщенный хлоридсеребряный электрод, 3 - исследуемый раствор, 4 - магнитная мешалка, 5 - магнитный стержень.
Стеклянный электрод
Стеклянный электрод относится к мембранным электродам, механизм действия которых все еще не вполне установлен, однако имеется немало состоятельных объяснений причин функционирования стеклянных электродов в качестве водородных электродов. И хотя в данном случае отсутствуют электрохимические реакции окисления и восстановления компонентов, обусловливающие возникновение разности потенциала на поверхности раздела стекло ‑ раствор, зависимость потенциалов стеклянных электродов от pH растворов вполне описывается уравнением, аналогичным уравнению Нернста. Стеклянный электрод представляет собой трубку, на конце которой наплавляют стеклянный шарик из специального стекла с толщиной стенок 0,01 ‑ 0,001 мм. Например, стекло марки «корнинг» имеет следующий состав: 22% Na2O, 6% СаО, 72% SiO2.
Шарик заполняется обычно 0,1 М раствором соляной кислоты с определенным значением рН (обычно 0,1 М НСl), насыщенный хлоридом серебра. Внутрь помещается серебряная проволочка, образуя хлоридсеребряный электрод сравнения (рис.2).
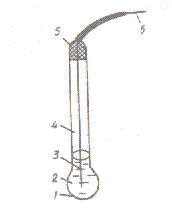
1 – стеклянная рН-чувствительная мембрана;
2 – 0.1 М раствор HCl, насыщенный AgCl;
3 – серебряная проволочка;
4 – стеклянная трубка;
5 – изоляция;
6 – токоотвод
Рис. 2 Стеклянный электрод для измерения рН:
Стеклянный электрод погружают в раствор, величину pH которого измеряют, в качестве электрода сравнения применяют каломельный (или хлоридсеребряный) электрод. Суммарный потенциал стеклянного электрода Е слагается из трех скачков потенциала ‑ скачка потенциала на границе исследуемый раствор ‑ стекло Е < 1,1, стекло ‑ раствор соляной кислоты и потенциала хлоридсеребряного электрода (рис.3).
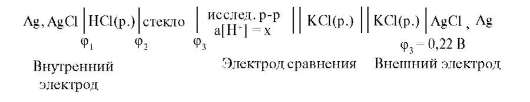
Рис.3.Схема измерительной цепи со стеклянным электродом
Ионообменная реакция сводится к обмену ионами водорода между внешним раствором и стеклом (NaGl):
Н+ + Na+Gl‾  Na+ + H+Gl‾
Na+ + H+Gl‾
раствор тв. раствор тв.
Поскольку активность ионов водорода во внутреннем растворе постоянна, потенциал стеклянного электрода становится мерой активности ионов водорода во внешнем растворе:
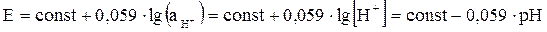
В величину const входят потенциалы внешнего и внутреннего электродов сравнения и, так называемый, потенциал асимметрии, возникающий в результате различных механических и химических воздействий на внешнюю и внутреннюю поверхность мембраны. Правильные результаты можно получить при регулярной калибровке стеклянного электрода по стандартным буферным растворам.
