Делокализованные многоцентровые связи. Теория резонанса
Используя концепцию двухэлектронных локализованных связей, можно построить структурные формулы большинства ковалентных соединений. Однако полученный результат не всегда достаточно хорошо согласуется с экспериментальными данными, в связи с чем представление о связях, соединяющих два атома пришлось дополнить представлениям о связях, объединяющих три, четыре и более атома. Подобные связи получили название делокализованных многоцентровых связей.
Рассмотрим вопрос об образовании многоцентровых связей на примере строения карбонат-аниона. Ион СО32- формально можно представить как результат соединения атома углерода, атома кислорода и двух однозарядных анионов кислорода, распределение электронов в которых показано ниже:
| 2s | 2p | 2s | 2p | 2s | 2p | |||||||||||||
| С | | | | | О | ¯ | ¯ | | | О- | ¯ | ¯ | ¯ | | ||||
sp2-гибридизация sp2-гибридизация sp3-гибридизация
Определим строение карбонат-аниона, используя представление о локализованных двухцентровых связях. Для этого необходимо предположить, что атомы углерода и кислорода, не несущие заряда, подвергаются sp2-гибридизации, что позволяет им соединиться двойной связью; ионы О- в состоянии sp3-гибридизации образуют с углеродом лишь по одной s-связи. В результате ион СО32- должен иметь форму равнобедренного треугольника, поскольку в образовавшейся частице двойная связь короче одинарных. В действительности же ион СО32- имеет форму равностороннего треугольника. Причиной наблюдаемого противоречия является произвольный выбор атома кислорода, присоединенного двойной связью. Действительно, иону СО32- отвечают три равноценные формы:
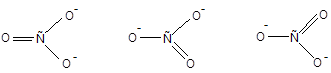
Подобные формы принято называть каноническими. Картина, отвечающая истинному строению иона СО32-, не соответствует ни одной из этих структур. Для описания таких частиц метод валентных связей использует специальный прием, получивший название «резонанса валентных схем» (Л. Полинг). Согласно теории резонанса реальная структура частицы является наложением всех ее канонических форм:

Согласующийся с экспериментальными данными результат можно получить, если предположить, что в карбонат-ионе происходит одновременное перекрывание четырех pz-орбиталей (если частица расположена в плоскости ху) всех атомов кислорода и атома углерода, приводящее к образованию четырехцентровой p-связи, охватывающей всю частицу. Делокализованную p-связь обозначают пунктиром. Одновременно происходит делокализация отрицательного заряда на все атомы кислорода, в результате чего строение СО32- выражается следующей формулой:
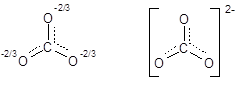
3.2.6. Неполярные и полярные связи. Типы ковалентных молекул
Пусть между атомами А и В, электроотрицательности которых равны cА и cВ, образуется локализованная ковалентная связь. При этом в зависимости от значений cА и cВ возможны три случая:
1. cА и cВ равны или очень близки по значениям. Образующаяся при этом общая электронная пара в равной мере принадлежит обоим взаимодействующим атомам, а возникающее электронное облако симметрично относительно ядер атомов А и В. Подобная связь называется неполярной. Неполярная связь реализуется в гомоядерных молекулах, например, в молекулах Cl2, P4, S8. Примером гетероядерной связи, очень близкой к неполярной, может служить связь Р-Н в молекуле фосфина РН3 (электроотрицательности водорода и фосфора по Полингу равны соответственно 2,20 и 2,19).
2. cА и cВ умеренно отличаются друг от друга. В этом случае общая электронная пара смещается в сторону атома с большей электроотрицательностью, в результате чего связь становится асимметричной. Такая связь называется полярной. Вследствие несимметричного распределения электронной плотности относительно ядер А и В полярная связь представляет собой диполь - электронейтральную систему, в которой центры тяжести положительного и отрицательного заряда не совпадают. Как и любому диполю, полярной связи присущи три количественные характеристики:
а) заряд, возникающий на полюсе диполя (q), по величине соизмерим с зарядом электрона (1,60×10-19 Кл),
б) длина диполя (l), равная расстоянию между полюсами диполя; эта величина принимает значения в пределах от нуля до 10-10 м;
в) дипольный момент, представляющий собой произведение абсолютного значения заряда полюса на длину диполя:
m = q×l
Дипольный момент является вектором, направленным от положительного полюса к отрицательному. Единица дипольного момента имеет размерность Кл×м; обычно дипольные моменты представляют собой величину порядка 10-30 Кл×м. На практике часто используется внесистемная единица - Дебай (D): 1D = 3,33×10-30 Кл×м. Значение дипольного момента относительно легко определяют экспериментально, измеряя диэлектрическую проницаемость вещества при разных температурах. Дипольные моменты некоторых молекул приведены в табл. 5.
Таблица 5.
Дипольные моменты некоторых молекул
| Молекула | m×1030, Кл×м | Молекула | m×1030, Кл×м |
| H2 | CO2 | ||
| N2 | H2O | 6,10 | |
| O2 | H2S | 3,40 | |
| HF | 6,36 | NO2 | 0,97 |
| HCl | 3,42 | NH3 | 4,94 |
| HBr | 2,63 | PH3 | 1,83 |
| HI | 1,40 | NF3 | 0,70 |
| CO | 0,33 | CCl4 | |
| NO | 0,53 | CHCl3 | 3,17 |
| O3 | 1,73 |
3. cА и cВ очень сильно отличаются друг от друга. В этом случае связывающая электронная пара переходит к атому с большей электроотрицательностью, в результате чего этот атом превращается в отрицательный ион, а его партнер - в положительный. Между образовавшимися ионами действуют электростатические силы, не связанные с перекрыванием электронных орбиталей. Возникающая при этом связь называется ионной.
Ковалентные молекулы могут содержать одну или несколько связей одинаковой или различной полярности. Векторная сумма дипольных моментов всех связей и неподеленных пар молекулы называется дипольным моментом молекулы. По значениям дипольных моментов молекулы могут быть подразделены на два типа:
1) неполярные молекулы, для которых дипольный момент равен нулю;
2) полярные молекулы, для которых дипольный момент принимает значения отличные от нуля.
Асимметричное распределение электронной плотности в молекуле по направлению полярных связей можно учесть, приписав атомам в молекуле некоторый эффективный заряд d (не путать с эффективным зарядом ядра). Эффективный заряд атома в молекуле можно рассматривать как меру полярности ковалентной связи. Так, например, для молекулы хлороводорода эффективный заряд на атоме хлора составляет -0,18 эл.ед., а на атоме водорода +0,18 эл.ед.
Полярность молекул определяется не только полярностью связей, но и геометрией частицы. Так, например, в молекулах BeF2 и H2O связи Be-F и Н-О полярны, однако дипольный момент молекулы фторида бериллия равен нулю, а для воды составляет 6,1×10-30 Кл×м. Это явление объясняется тем, что для линейной молекулы BeF2 векторная сумма двух противоположно направленных дипольных моментов равна нулю. Молекула воды - угловая молекула, в результате сумма дипольных моментов связей Н-О нулю не равняется.

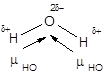
На полярность молекул оказывает также влияние ориентация дипольных моментов неподеленных электронных пар молекулы. Так, молекулы NH3 и NF3, имеющие одинаковую форму, существенно отличаются по полярности (рис. 11). Это объясняется тем, что электроотрицательность азота выше электроотрицательности водорода, но ниже электроотрицательности фтора. В результате в молекуле аммиака дипольные моменты связей N-H направлены от водорода к азоту; суммирование их с дипольным моментом неподеленной пары приводит к увеличению дипольного момента молекулы NH3. В случае молекулы трифторида азота дипольные моменты связей N-F и неподеленной пары направлены в противоположные стороны и при сложении частично компенсируют друг друга.

Рис. 11. Дипольные моменты связей и неподеленной электронной пары
в молекулах NH3 и NF3.
Если та или иная молекула испытывает действие внешнего электростатического поля, в ней происходит перераспределение электронной плотности, центры тяжести положительного и отрицательного заряда смещаются, в результате чего неполярная молекула может стать полярной, а дипольный момент полярной молекулы возрастает. Этот процесс называется поляризацией молекулы, а возникающий при этом диполь - наведенным или индуцированным диполем. Значение индуцированного диполя зависит от природы молекулы и напряженности поля (Е):
mЕ = a×Е
Величина a в приведенном уравнении называется поляризуемостью молекулы. Чем больше поляризуемость, тем легче деформируется молекула под воздействием внешнего поля. Источником внешнего электрического поля могут являться ионы или полярные молекулы, окружающие деформируемую частицу.
