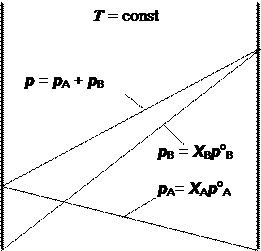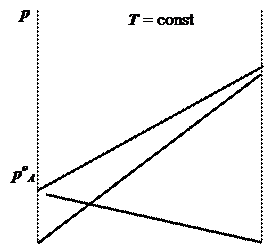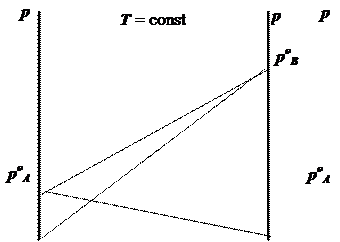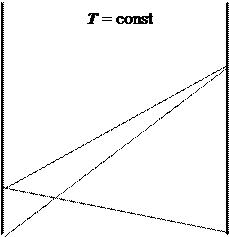Двухкомпонентные растворы летучих жидкостей. Закон Рауля
В этом разделе мы остановимся на давлении пара компонентов бинарного (двухкомпонентного) раствора. Равновесное давление пара является мерой способности молекул переходить из жидкой фазы в паровую. Эта способность больше при высоких температурах и меньше - при пониженных. Она также снижается при уменьшении числа молекул жидкости, которые могут переходить в пар. Если в растворе половина молекул воды, а половина молекул - какого-либо нелетучего вещества, то давление пара воды над раствором должно быть вдвое меньше, чем над чистой водой. В общем случае если ХА - молярная доля компонента А в растворе и pАо - давление пара чистого вещества А при данной температуре, то давление его пара над раствором pАопределяется соотношением
pA = ХA poA.
Это же справедливо и для второго компонента раствора (В):
pВ = ХВ poВ .
Эти уравнения являются математическим выражением закона Ф.М.Рауля (1882):
Давление пара компонента над раствором пропорционально его молярной доле в растворе.
Коэффициентом пропорциональности в этих уравнениях служит давление пара над чистым компонентом poА или poВ.
На практике часто бывает удобнее пользоваться другой формой уравнения, связывающей параметры, относящиеся к обоим компонентам. Преобразуя выражение для компонента А, можно получить:
ХA = pA/poA
или, так как ХA + ХВ = 1,
1 - ХA= 1 - pA/poA = ХB,
откуда
| poA - pA ¾¾¾¾¾ = ХB , poA |
что соответствует такой формулировке закона Рауля:
Относительное понижение давления пара растворителя над раствором численно равно молярной доле растворённого вещества.
Разность poA - pA называется понижением давления пара растворителя над раствором по сравнению с чистым растворителем, а выражение (poA - pA)/poA - относительным понижением давления пара растворителя. Относительное понижение давления пара растворителя не зависит от природы растворителя и поэтому относится к так называемым коллигативным свойствам растворов(свойствам, которые зависят только от концентрации компонентов). Эта формулировка и соответствующее ей математическое выражение наиболее удобны при рассмотрении свойств растворов нелетучих веществ в летучих растворителях.
В соответствии с законом Дж. Дальтона(1801):
Общее давление пара над раствором равно сумме парциальных давлений компонентов
можно записать:
p = pA + pB
или
p = ХA poA + ХB poB
Поскольку ХA+ ХB = 1, то
p = poA (1 - ХB) + poB ХB
и окончательно
p = poA + ХB(pB - pA) и p = poB + ХA(pA - pB),
откуда следует, что полное давление пара над раствором является линейной функцией молярной доли любого его компонента.
Закон Рауля справедлив во всей области концентраций только для идеальных растворов. Более того, существует даже такое определение идеальных растворов, как растворов, подчиняющихся закону Рауля. Объяснение этого заключается в том, что если силовые поля всех молекул веществ А и В в растворе одинаковы, то одинаковы и силы притяжения однородных и разнородных молекул (FА-А = FВ-В = FА-В). При этом число молекул каждого компонента, переходящих в пар, уменьшается пропорционально понижению молярной доли вещества в растворе.
Закон Рауля может быть изображен графически в виде диаграммы в координатах “давление - состав” (рис. 7.1).
|
Рис. 7.1. Диаграмма “давление - состав” для идеального раствора
На таких диаграммах принято слева помещать тот компонент, который в чистом виде обладает меньшим давлением насыщенного пара. Например, допустим, что в данном случае это компонент А. Ось абсцисс (ось состава) на таких диаграммах ограниченна; на ней одновременно откладывается содержание обоих компонентов, обычно в молярных долях или в молярных процентах. Из точек, соответствующих чистым компонентам А и В, восстанавливаются две оси ординат – оси давлений. Каждая диаграмма строится при заданной постоянной температуре.
Точки, отвечающие давлениям насыщенного пара чистых компонентов (роА и роВ), соединяются прямыми линиями с крайними точками оси состава и друг с другом. Две первые линии иллюстрируют повышение парциального давления пара каждого компонента с повышением его молярной доли в растворе в соответствии с законом Рауля. Третья линия является иллюстрацией закона Дальтона и одновременно линейности зависимости общего давления пара от молярной доли любого из компонентов.
Отклонения от закона Рауля
В большинстве случаев реальные растворы подчиняются закону Рауля только при очень малых (не превышающих нескольких молярных процентов) концентрациях одного из компонентов. При концентрациях компонентов, соизмеримых друг с другом, в той или иной степени наблюдаются отклонения от закона Рауля. Эти отклонения проявляются или в увеличении общего давления пара по сравнению с вычисленным по этому закону (положительные отклонения), или в уменьшении его (отрицательные отклонения). Причинами отклонений от закона Рауля являются 1) различие в интенсивности сил притяжения между однородными и разнородными молекулами и 2) изменение размеров частиц, присутствующих в растворах.
Если разнородные молекулы взаимодействуют между собой слабее, чем однородные (FА-А > FА-В < FВ-В), то вклад каждого компонента в общее давление пара будет больше, чем предсказывается законом Рауля:
pA > ХApoA и pB > ХBpoB .
При этом наблюдается положительное отклонение от закона Рауля. Так ведёт себя, например, система ацетон - дисульфид углерода. Растворы с положительными отклонениями от закона Рауля образуются, как правило, с поглощением теплоты.
В растворах, состоящих из веществ другой природы, притяжение между разнородными молекулами может оказаться сильнее, чем между однородными (FА-А < FА-В > FВ-В). Это затрудняет испарение каждого компонента, и общее давление пара над раствором становится меньше, то есть наблюдается отрицательное отклонение от закона (например, в системах вода - этанол, ацетон - хлороформ):
pA < ХApoA и pB < ХBpoB
Растворы с отрицательными отклонениями от закона Рауля образуются, как правило, с выделением теплоты.
Изменение среднего размера частиц жидкости происходит в результате ассоциациимолекул из-за образования водородных связей или, наоборот, распада ассоциатов на отдельные молекулы или на ассоциаты, содержащие меньшее число молекул. Так, частицы в чистой уксусной кислоте являются димерами (СН3СООН)2, во фтороводородной кислоте - состоят из шести молекул (HF)6, в воде её молекулы объединяются в ассоциаты с ещё бóльшим и, как правило, с различным числом молекул (Н2О)n. При смешении компонентов такие ассоциаты могут распадаться или, наоборот, возникать. Кроме того, часто имеет место сольватация, т. е. образование ассоциатов, содержащих одновременно молекулы растворённого вещества и растворителя, - сольватов или в случае воды - гидратов. Распад ассоциатов приводит к положительным отклонениям от закона Рауля, а их образование - к отрицательным. Графическое изображение отклонений представлено на рис. 7.2 и 7.3.
Отклонения от закона Рауля могут быть большими или малыми. Малыми считаются такие, когда общее давление пара над раствором любого
|
Рис. 7.2. Диаграмма “давление - состав” для раствора с малыми
положительными (а) и отрицательными (б) отклонениями от закона Рауля.
Сплошная линия - теоретическое давление пара,
пунктирная - реально наблюдаемое давление.
 |
Рис. 7.3. Диаграмма “давление - состав” для раствора с большими положительными (а) и отрицательными (б) отклонениями от закона Рауля.
Сплошная линия - теоретическое давление пара,
пунктирная - реально наблюдаемое давление.
состава не превышает давления пара над чистым более летучим веществом
(при положительных отклонениях) или не становится меньше давления пара над чистым менее летучим веществом (при отрицательных отклонениях). При больших отклонениях на кривых общего давления пара появляются экстремумы - максимумы в случае положительных отклонений или минимумы в случае отрицательных.
Первый закон Коновалова
Любые жидкости, как чистые, так и смеси, закипают тогда, когда давление пара над ними становится равным атмосферному давлению. Чистые жидкости кипят при постоянной температуре, являющейся характерной константой при каждом данном давлении – при своей температуре кипения Ткип. Это обусловлено тем, что пар над кипящей чистой жидкостью имеет тот же состав и теплота испарения жидкости равна теплоте конденсации пара. Если температура кипения измерена при стандартных условиях, т. е. при нормальном атмосферном давлении, то она называется нормальной температурой кипенияданного вещества Токип.
Растворы же в большинстве случаев при кипении ведут себя иначе. Так как состав пара над раствором отличается от состава жидкости и к тому же непрерывно изменяется при выкипании жидкой фазы, то кипение происходит не при фиксированной температуре, а в некотором интервале температуры. Это связано с первым законом Д.П.Коновалова (1880 - 81):