I5. органические соединения азота
Основными типами азотсодержащих органических соединений являются амины (N+3), соли аммония (N+4) и нитросоединения (N+5).
НИТРОСОЕДИНЕНИЯ
Определение. Нитросоединения – производные углеводородов формулы R–NO2, содержащие нитрогруппу, связанную с углеводородным радикалом. В нитросоединениях атом азота непосредственно соединен с атомом углерода, в то время как в изомерных эфирах азотистой кислоты (нитритах) азот связан с углеродом через кислородный атом:

нитросоединения эфиры азотистой кислоты
Номенклатура.За основу названия нитроалканов берется название соответствующего алкана; перед основой ставятся приставка «нитро» и цифра, показывающая положение нитрогруппы в основной цепи.
Строение нитрогруппы.В нитрогруппе обе NO-связи имеют длину – 0,122 нм (для N=O 0,115 нм, для N–O 0,136 нм). Реальное распределение электронной плотности в нитрогруппе выражается в виде гибрида двух резонансных структур:
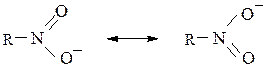
Классификация.В зависимости от природы углеводородного радикала нитросоединения бывают алифатическими (первичными, вторичными или третичными, что зависит от того, при каком атоме углерода – первичном, вторичном или третичном находится нитрогруппа) и ароматическими (нитрогруппа связана с бензольным кольцом).
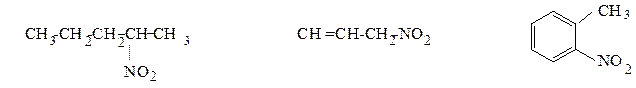
2-нитропентан (алифатическое, 3-нитропропен-1 (алифатическое, о-нитротолуол
предельное, вторичное) непредельное, первичное) (ароматическое)
Получение.Нитросоединения получают нитрованием углеводородов или реакцией нитрита серебра с алкилгалогенидами.
1) Нитрование алканов осуществляется в газовой фазе разбавленной азотной кислотой (реакция Коновалова) (110 – 140 0C).
СH3 СH3
| |
СH3–CH–CH3 + HNO3 ¾® СH3–C–CH3 + H2O
|
NO2
2-нитро-2-метилпропан
Это радикальный процесс (SR):

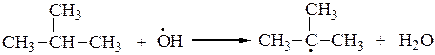
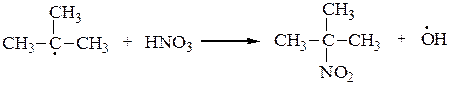
или
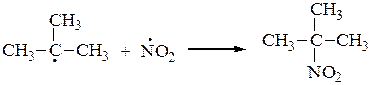
Молекула диоксида азота, образующаяся в процессе нитрования алканов, имеет неспаренный электрон, придающий ей свойства свободного радикала. Этот электрон делокализован на двух атомах кислорода и атоме азота:
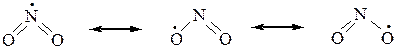
Это означает, что реакционным центром в NO2 является либо атом азота, либо один из атомов кислорода, а сама молекула обладает двойственной реакционной способностью. Поэтому молекула NO2, реагируя со свобод-ными углеводородными радикалами за счет одного из центров, образуя не только: нитросоединения, но и изомерные им эфиры азотистой кислоты (R–O–N=O).
Нитрование ароматических углеводородов по бензольному кольцу осуществляется нитрующей смесью по механизму электрофильного замещения (SЕ) и является основным методом синтеза ароматических нитросоединений.

изопропилбензол п-нитроизопропилбензол о-нитроизопропилбензол
Для введения нитрогруппы в боковую цепь ароматических углеводородов используют метод Коновалова (реакция SR):
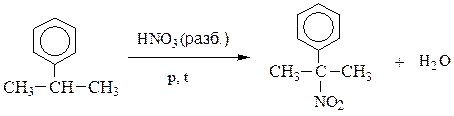
α-нитроизопропилбензол
2). Галогеналканы взаимодействуют с нитритами серебра в неполярных растворителях или щелочных металлов в сильно полярных растворителях
(CH3)2СHСН2–I + AgNO2 ¾® (CH3)2СHCH2–NO2 + AgI ↓
йодистый изобутил 1-нитро-2-метилпропан
В сольватирующих растворителях (вода, спиртах) могут образовываться также нитриты R–O–N=O (эфиры азотистой кислоты).
Физические свойства.Нитросоединения – жидкие или твердые вещества, малорастворимые в воде, растворяются в органических растворителях. Полинитросоединения окрашены в желтый или оранжевый цвета. Соединения, содержащие несколько нитрогрупп при нагревании или детонации взрываются.
Химические свойства.
1). Восстановление (каталитическое гидрирование, использование комплексных гидридов металлов нитросоединений приводит к образованию первичных аминов:
(Ni)
(CH3)2СH–NO2 + 3 H2 ¾® (CH3)2СH–NH2 + 2 H2O
Аналогично нитроалканам каталитическое гидрирование, восстановление растворяющимся металлом или действие восстановителем в кислой среде приводит к образованию соответствующих ароматических первичных аминов
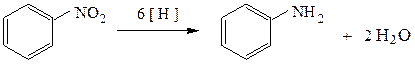
При восстановлении ароматических нитросоединений в щелочной среде в зависимости от условий реакции можно выделить ряд промежуточных продуктов. Так, при восстановление нитробензола до анилина в кислой среде протекает через стадии образования нитрозобензола и фенилгидроксиламина. В щелочной среде эти соединения конденсируются с образованием азоксибензола, а затем и продуктов более глубокого восстановления - азобензола и гидразобензола. При полном восстановлении нитробензола в кислой среде образуется анилин. Впервые анилин синтезирован Н.Н. Зининым при восстановлении сероводородом:
C6H5NO2 + 3 H2S —¾® C6H5NH2 + 2 Н2О + 3 S
Сегодня анилин получают из нитробензола с использованием в качестве восстановителей железа, цинка или олова в НС1, гидросульфида аммония и водорода или гидразина на никелевом катализаторе:
C6H5NO2 + 3 Zn + 6НС1 ¾¾® C6H5NH2 + 3 ZnCl2 + 2H2O
При восстановлении нитробензола в мягких условиях [цинковая пыль в водном растворе или пентакарбонил железа Fe(CO)5] процесс останавливается на стадии образования нитрозобензола. Восстановление нитробензола в слабокислой среде с использованием цинка в растворе хлорида аммония выделяется N-фенилгидроксиламин:
C6H5NO2 + 2 Zn + 4 NH4C1 ¾¾® C6H5NHOH + 2 [Zn(NH3)2]Cl2 + H2O
Восстановление нитробензола в щелочной среде приводит к образованию азоксибензола, азобензола и гидразобензола. Так, при восстановлении нитробензола метилатом натрия выделяется азоксибензол:
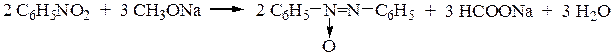
Действием алюмогидридом или станнитом натрия на нитробензол получают азобензол:
2C6H5NО2 + 4Na2SnO2 ¾¾® C6H5-N= N-C6H5 + Na2SnO3 + 8NaOH
Более глубокое восстановление до гидразобензола наблюдается при использовании цинковой пыли в щелочной среде:
2C6H5NO2 + 5Zn + 5NaOH + Н2О ¾® C6H5-NH-NH-C6H5 + 5NaHZnО2
2). Реакции, связанные с подвижностью α-атомов водорода.
Характерны только для первичных и вторичных нитроалканов.
а) Первичные и вторичные нитроалканы конденсируются в присутствии щелочей с альдегидами (например, с формальдегидом), образуя нитроспирты (реакция Генри).
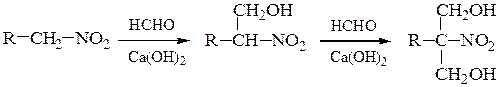
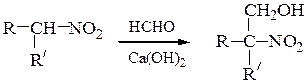
Реакция протекает как нуклеофильное присоединение по карбонильному атому углерода, а роль a-карбаниона в конценсации выполняет нитросоединение.
б) Действие щелочей.Первичные и вторичные нитросоединения растворяются в водных растворах щелочей с образованием солей, так как атомы водорода при a-углеродном атоме, связанном с очень сильным электроноакцептором - нитрогруппой, обладают кислотной подвижностью
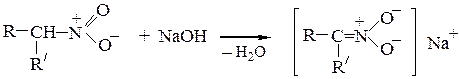
При подкислении раствора сначала образуется аци-нитросоединение, которое затем перегруппировывается в исходное нитросоединение:
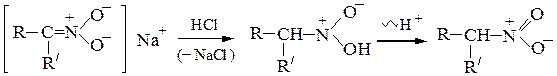
Нитросоединения относятся к псевдокислотам – нейтральным соединениям, способным образовывать соли. Третичные нитросоединения со щелочами не реагируют.
в) Первичные нитросоединения с азотистой кислотой образуют нитроловые кислоты, а вторичные – псевдонитролы:
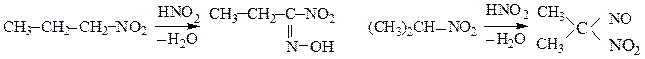
АМИНЫ
