Институт техносферной безопасности
Институт техносферной безопасности
Кафедра химии метрологии и стандартизации
Неорганическая химия
Методические указания к выполнению контрольных работ для бакалавров первого курса заочной формы обучения технологических направлений
Краснодар
Составители: д.т.н. , проф. Т.Н. Боковикова
к.х.н., доц. Л.А. Марченко
УДК 541(075)
Неорганическая химия:методические указания и контрольные работы для студентов первого курса заочной формы обучения технологических направлений. /Сост.: Т.Н. Боковикова, Л.А. Марченко, ; Кубан. гос. технол. ун-т. каф. Химии , метрологии и стандартизации- Краснодар.: Изд. КубГТУ, 2017.- 78 с.
Составлены в соответствии с программой по курсам « Общей и неорга-нической химии » и «Неорганической химии » для студентов технологи-ческих специальностей заочной формы обучения.
Табл. 5. Библиогр.: 11 назв.
Рецензенты: д-р хим.наук, проф. кафедры ХМиС, Пасконин В.В.
д-р хим.наук, проф. кафедры , проф. Ясьян Ю.П.
Содержание
| Введение | ||
| Инструкция по работе с учебно – методическим пособием | ||
| Программа дисциплины | ||
| Конспект лекций по курсу | ||
| Контрольная работа 1 | ||
| Строение атома. Химическая связь | ||
| Классы неорганических соединений | ||
| Химическая термодинамика. Кинетика. Химическое равновесие | ||
| Общие свойства растворов | ||
| Реакции обмена в растворах электролитов. Гидролиз | ||
| Окислительно- восстановительные реакции | ||
| Контрольная работа 2 | ||
| Химия неметаллов и их соединений | ||
| Химические и электрохимические свойства металлов. | ||
| Комплексные соединения | ||
| Химия d- элементов | ||
| Вопросы для подготовки к экзамену | ||
| Список рекомендуемой литературы | ||
| Приложения | ||
ВВедение.
Предлагаемые методические указания составлены в целях обобщения и систематизации материала по курсу общей и неорганической химии в соответствии с программой для студентов технологических специальностей (стандарт Е 0501).
Оно включает в себя конспект лекций по наиболее важным темам курса. К каждой теме разработаны варианты контрольных заданий, даны примеры выполнения этих заданий с указанием литературных источников.
1. Цели и задачи изучения дисциплины
Целью изучения дисциплины является теоретическая и практичес-кая подготовка студентов по основным (фундаментальным) разделам неор-ганической химии с учетом современных тенденций развития химической науки, что обеспечивает решение выпускником задач будущей професси-ональной деятельности. При этом кроме получения конкретных знаний, необходимых для профессиональной подготовки, имеется в виду и цель формирования у студентов целостного естественнонаучного мировоззрения. Дисциплина является естественнонаучной.
Задачами дисциплины является изучение:
- современных представлений о строении вещества, о зависимости строения и свойств веществ от положения составляющих их элементов в Периодической системе и характера химической связи применительно к задачам химической технологии;
- природы химических реакций, используемых в производстве химических веществ и материалов;
- кинетического и термодинамического подходов к описанию химических процессов с целью оптимизации условий их практической реализации;
- важнейших свойств неорганических соединений и закономерностей их изменения в зависимости от положения составляющих их элементов в Периодической системе.
Программа дисциплины
| 1. Введение. Теория строения атома. Современные представления о строении атома. Уравнение Луи де Бройля. Принцип неопределенности Гейзенберга. Уравнение Шредингера, квантовые числа электрона. Многоэлектронные атомы. Принципы формирования электронной оболочки атома. |
| 2. Периодическая система химических элементов с точки зрения теории строения атомов.Периодический закон Д.И.Менделеева в свете теории строения атома. Периодическая система как графическое выражение пери-одического закона, ее структура с позиций теории строения атома. Перио-дическое и непериодическое изменение параметров атомов и свойств хими-ческих элементов. Энергия ионизации и сродства к электрону, электроотри-цательность. Изменение кислотно-основных свойств и окислительно-вос-становительных свойств соединений химических элементов по периодам и подгруппам. Их зависимость от радиусов атомов и от степени окисления. |
| 3. Химическая связь и строение молекул.Квантово-механическая теория ковалентной связи. Основные положения метода валентных связей (МВС), Параметры и свойства ковалентной связи. Гибридизация атомных орбита-лей. Ионная связь . Строение веществ в конденсированном состоянии, межмолекулярные взаимодействия, водородная связь. |
| 4.Энергетика химических превращений. Энергетически е характеристики химических реакций. Первое начало термодинамики. Превращения энергии и работы в химических процесссах. Термохимия. Понятие об энтальпии. Эндо- и экзотермические реакции. Закон Гесса. Стандартное состояние и стандартная энтальпия образования вещества. Расчеты тепловых эффектов реакций. Второе начало термодинамики. Понятие энтропии. Оценка знака изменения энтропии в химических реакциях. Энергия Гиббса. Уменьшение энергии Гиббса как термодинамический критерий возможности самопро-извольного протекания процесса в закрытых системах. Стандартное изменение энергии Гиббса в реакции. Зависимость изменения энергии Гиббса от температуры, давления и концентрации реагирующих веществ. Особенности протекания газофазных, жидкофазных, твердофазных реакций. Роль энтальпийного и энтропийного факторов в определении направления процесса. |
| 5. Химическая кинетика и катализ.Понятие о скорости химической реакции. Скорость химиических реакций в гомогенных и гетерогенных системах, ее зависимость от различных факторов. Закон действующих масс. Порядок и молекулярность химической реакции. Константа скорости химической реакции, ее физический смысл. Правило Вант-Гоффа, энергия актива-ции, уравнение Аррениуса, Понятия об активированном комплексе, механизме химических превращений и цепных реакциях. Катализаторы, их разновидности. Катализ гомогенный и гетерогенный, его механизмы. Роль катализа в технологических процессах. Химическое равновесие. Константа химического равновесия. Смещение химического равновесия. |
| 6. Растворы и другие гетерогенные системы Растворы как многокомпо-нентные системы. Физическая, химическая и физико-химическая теории растворов. Зависимость растворимости веществ от различных факторов. Способы выражения концентрации растворов. Растворы неэлектролитов. Законы Рауля и Вант-Гоффа. Осмос и осмотическое давление. Растворы электролитов. Теория электролитической диссоциации. Теория растворов сильных и слабых электролитов. Ионная сила и активность ио-нов. Равновесие в растворах электролитов. Смещение ионного равновесия. Произведение растворимости. Диссоциация воды, ионное произведение воды, водородный показатель. Кислотно-основные индикаторы. Гидролиз солей и ковалентных соединений. Степень и константа гидро-лиза, влияние различных факторов на них. Смещение равновесия в протоли- тических процессах. |
| 7. Окислительно- восстановительные реакции. Окислительно -восста-новительные процессы как реакции переноса электрона. Важнейшие окис-лители и восстановители. Составление уравнений окислительно-восстано-вительных реакций, протекающих в водных растворах. Метод ионно-моле-кулярных полуреакций. Типы окислительно-восстановительных реакций. Количественные характеристики окислительно-восстановительных пере-ходов. Стандартные условия и стандартный потенциал полуреакции. Урав- нение Нернста. Направление протекания ОВ-реакций. |
| 8. Свойства неметаллов и их соединений. Химия неметаллов. Общая характеристика элементов V-VII групп главных подгрупп, химическая связь в молекулах простых веществ. Нахождение в природе. Получение простых веществ, их химические свойства, изменение химической активности по подгруппе. Водородные соединения. Кислородсодержащие сое динения. |
| 9. Общие свойства металлов. Особенности кристаллического строения металлов: металлические кристаллические решетки, металлическая связь, зонная теория проводимости. Физические свойства металлов. Электродные потенциалы. Ряд стандартных электродных потенциалов. Химические свойства металлов: их взаимодействие с неметаллами, водой, с растворами солей, с растворами щелочей, с оксидами металлов, с кислотами, со смесями кислот, с щелочными расплавами окислителей. Металлы в природе, способы их получения. Коррозия металлов и их защита от коррозии. |
| 10. Комплексные соединения. Теория Вернера. Понятия: комплексное сое-динение, комплексообразователь, лиганд и его дентантность, координацион-ное число, внутренняя и внешняя сферы .Классификация комплексных соединений. Номенклатура комплексных соединений. Квантово-механи-ческие теории комплексных соединений: метод валентных связей и теория кристаллического поля. Свойства комплексных соединений, их диссоциация в растворе. Константы нестойкости и устойчивости комплексных соедине-ний. Методы разрушения комплексных содинений . |
| 11. Химия d- элементов I-VII групп и их соединений. Общая характеристика элементов Нахожде-ние в природе . Химические свойства простых веществ . Оксиды, гидроксиды и соли. Их кислотно- основные и окислительно-восстановительные свойства. Комплексные соединения этих элементов. |
| 12. Химия р- элементов и их соединений. Общая характеристика элемен-тов . Нахождение в природе. Физические и химические свойства .Оксиды, гидроксиды и соли. Роль соединений в окислительно-восстановительных реакциях. |
Конспект лекций
СТРОЕНИЕ АТОМА
До конца XIX века считалось, что атомы являются неделимыми час-тицами, однако открытие катодных лучей, термоэлектронной эмиссии, фо-тоэффекта, явления радиоактивности, говорило о том, что атом частица сложная. В начале ХХ века появляются первые модели строения атома, которые были предложены Резерфордом, Бором, Зоммерфельдом, однако недостатком всех этих теорий было то, что их авторы пытались применить к микрообъектам законы классической механики, которым они не подчиняют-ся.
Было установлено что атом состоит из ядра и электронной оболочки. Ядро имеет положительный заряд. Величина заряда определяется числом протонов. Каждый протон имеет единичный положительный заряд. Кроме протонов в состав ядра входят электронейтральные частицы - нейтроны. Их общее название - нуклоны.
Число нуклонов называется массовым числом атомов, его обозначают символом А:
А=Z+N
где Z- число протонов, а N- число нейтронов.
Массовое число приблизительно равно массе атома, так как масса электронов незначительна, и ею можно пренебречь. Порядковый номер элемента в таблице Менделеева соответствует числу протонов в ядре (Z), т.е. он соответствует заряду ядра, следовательно разность между массовым числом (А) и его порядковым номером является числом нейтронов (N).
N=A-Z
Для одного и того же элемента атом всегда содержит определённое число протонов, а число нейтронов является различным. Значит один и тот же элемент может иметь разные массовые числа. Атомы, имеющие одинаковое число протонов (Z), но разное число нейтронов (N), называются изотопами.
Массовые числа элементов, указываемые в периодической таблице, яв-ляются средней арифметической величиной масс всех изотопов элементов и поэтому часто имеют дробные значения.
Ядро атома не участвует в химических реакциях. Химические свойства элементов определяются только числом электронов и строением их элект-ронной оболочки.
Современная теория строения атома базируется на законах квантовой механики, одним из важнейших положений которой является представле-ние о двойственной природе быстро движущихся микрообъектов , которые проявляют себя и как частицы, и как волны. Впервые дуализм свойств мик-рочастиц был установлен в 1905 году Энштейном для квантов света, в 1924 году Луи де Бройль распространил эти представления на все микрочастицы, в том числе и на электроны. Математическое выражение уравнения Луи де Бройль имеет вид :
υ = h / mv
Двойственная природа электрона приводит к тому, что его движение не может быть описано определенной траекторией, траектория размывается, возникает « полоса неопределенности» в которой находится электрон, чем точнее мы будем стараться определить его местонахождения, тем меньше узнаем о скорости его движения. Второй закон квантово-волновой теории формулируется следующим образом : Невозможно одновременно с любой заданной точностью определить координаты электрона и его скорость.
Одной из основных характеристик движущегося электрона является волновая функция Y (пси). Сама волновая функция физического смысла не имеет, а |Y| 2 показывает вероятность нахождения электрона в данной точке пространства. Более точным является выражение |Y| 2 dv -это веро-ятность нахождения электрона в элементарном объеме dv , она оценивается уравнением Шреденгера :
НY = ЕY ,
где Н – оператор Гамельтона, указывающий на последовательность операций с Y.
Данное уравнение имеет несколько решений, т.е. Y квантуется, однако волновая функция должна удовлетворять ряду условий : она должна быть однозначной, конечной, непрерывной и нормируемой.
В качестве модели состояния электрона в атоме в квантовой механике принято представление об электронном облаке. Пространство вокруг ядра, пребывание электрона в котором составляет 80 % называется атомной орби-талью. Волновая функция, являющаяся решением уравнения Шреденгера есть атомная орбиталь.
Волновая функция Y всегда содержит безразмерные параметры, кото-рые могут принимать ряд целочисленных значений. Эти величины называ-ются квантовыми числами.
n - главное квантовое число, характеризует запас энергии на энергетическом уровне и размеры атомной орбитали. Изменяется от 1 до 7, в электронных формулах обозначается арабскими цифрами;
l – орбитальное квантовое число, характеризует запас энергии на подуровне и форму атомной орбитали. Изменяется от 0 до (n – 1), принимает n значений, в электронных формулах обозначается латинскими буквами s- ( l = 0) , p- ( l =1 ), d- (l = 2 ) , f ( l = 3 ).
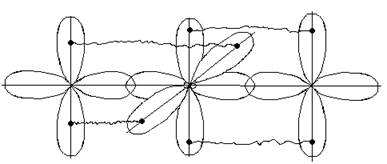
Электроны s-подуровня имеют орбиталь в виде полного шара, р-подуровня в виде объемной восьмерки, а d-подуровня имеют две формы орбиталей: веретена и розетки, у f-электронов орбитали имеют более сложную форму.
m – магнитное квантовое число, показывает число ориентаций атомных орбиталей в пространстве. Изменяется от –l до + l через 0, принимает
(2l + 1) значений. Так шарообразная s-орбиталь может иметь только одну ориентацию, а р - три ориентации , d –пять , f – семь.
Отсюда следует, что s - подуровень состоит из одной орбитали, р-подуровень – из трех орбиталей , d – из пяти орбиталей, f – подуровень из семи орбиталей.
s – спиновое квантовое число показывает направление вращения электрона вокруг своей оси, принимает два значения, равные + 1/ 2.
ХИМИЧЕСКАЯ СВЯЗЬ
Первые попытки объяснить причины образования химической связи предпринимались еще в Х1Х веке ‚ однако только на базе работ Косселя и Льюиса в 1916 году зародились фундаментальные гипотезы, которые в нас-тоящее время являются основой наших представлений о химической связи. Коссель и Льюис предположили‚ что образование химической связи связано с тем‚ что каждый атом стремится приобрести устойчивую электронную конфигурацию следующего за ним инертного газа. Образование этой элект-ронной конфигурации они объясняли по разному : Льюис говорил, что она образуется в результате обобществления электронов, т.е. за счет образования общих электронных пар, Коссель связывал ее образование с передачей элек-тронов от менее электроотрицательного атома более электроотрицательно-му, что приводило к дальнейшем взаимодействию образовавшихся ионов за счет сил электростатического притяжения. Таким образом, представления Льюиса объясняли образование ковалентной связи, Косселя – ионной.

 В зависимости от электроотрицательности атомов, образовавших химическую она делится на ковалентную неполярную ( = 0, где =|E1-E2 |
В зависимости от электроотрицательности атомов, образовавших химическую она делится на ковалентную неполярную ( = 0, где =|E1-E2 |
E1 и E2 - электроотрицательности атомов), ковалентную полярную
 ( < 2,0 ), ионную ( D >2,0). В этом случае электроны полностью смещаются к более электроотрицательному атому , свяазуется за счет сил электростатического притяжения разноименно заряженных ионов:
( < 2,0 ), ионную ( D >2,0). В этом случае электроны полностью смещаются к более электроотрицательному атому , свяазуется за счет сил электростатического притяжения разноименно заряженных ионов:



 Na× + Cl [Na]+ [ Cl ]-
Na× + Cl [Na]+ [ Cl ]-
Химическая связь характеризуется тремя параметрами – длина связи, угол связи и энергия связи. Длина связи – это равновесное расстояние между центрами ядер в молекуле. Она зависит от радиусов атома и кратности связи. Энергия связи - это та энергия, которую нужно затратить на разрыв связи, чем меньше длина и кратность связи, тем выше энергия связи. Угол связи – это угол между воображаемыми линиями, проведенными через центры атомов.
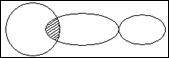
В 1927 году Гейтлер и Лондон решили уравнение Шреденгера для молекулы водорода, рассчитав энергию молекулы водорода для различных межатомных расстояний, они показали что возможно два решения уравнение Шреденгера - волновая функция , получившая название симметричной функции (спины атомов водорода антипараллельны) и волновая функция - , получившая название асимметричной функции ( спины атомов водорода паралельны) . В случае симметричной функции становится возможным передвижение электронов в поле обоих ядер, что приводит к значительному увеличению электронной плотности в пространстве между ядрами. Между ядрами появляется область с высокой плотностью отрицательного заряда, который стягивает положительно заряженные ядра. Притяжение уменьшает потенциальную энергию системы - возникает химическая связь, при этом сферы облаков не касаются друг друга, а перекрываются. Наоборот, когда спины параллельны плотность электронного облака в пространстве между ядрами падает до нуля, электроны выталкиваются из пространства между ядрами, химическая связь не образуется. Представления Гейтлера и Лондона о механизме образования химической связи послужили основой для разработки теории химической связи, получившей название метода валентных связей ( МВС).
Основные положения метода валентных связей :
1. Химическая связь образуется между двумя атомами с антипараллель- ными спинами, при этом происходит перекрывание волновых функций электронов, между атомами появляется зона с повышенной элект-ронной плотностью, что приводит к уменьшению потенциальную энергию системы.
2. Связь располагается в том направлении, в котором возможность перекрывания волновых функций электронов, образующих связь является наибольшей.
3. Из двух орбиталей атома наиболее прочную связь образует та, которая сильнее перекрывается с орбиталью другого атома.
4. Химическая связь носит локализованный характер.
Рассмотрим в рамках МВС свойства ковалентной связи – ее насыщае-мость, направленность и поляризуемость.
Насыщаемость.
Вследствие насыщаемости молекулы имеют определенный состав и существуют в виде частиц определенной структуры. Данное свойство ковалентной связи неразрывно связано с таким понятием как валентность. Валентность характеризует способность атома образовывать определенное число связей. Поскольку пребывание электрона в поле двух ядер энергетически выгоднее, чем в поле своего ядра в образовании химической связи принимают участие все одноэлектронные облака, т.е. ковалентность (валентность) определяется числом неспаренных электронов. Число неспаренных электронов может увеличиваться в результате возбуждения, при котором двухэлектронные облака распадаются на одноэлектронные. Однако возбуждение атомов до нового валентного состояния требует затраты определенной энергии, поэтому возбуждение возможно только в тех случаях, когда затрата энергии компенсируется энергией которая выделяется при образовании химических связей. Возбуждение возможно только в пределах своего энергетического уровня.
Например :
16S ... 3s23p4 __  — — — K = 2
— — — K = 2 
Так как сера является элементов третьего периода , то у атома имеются свободные орбитали на d- подуровне, на которые могут переходить спаренные электроны при возбуждении :
— — — — —
16S*... 3s23p33d1 — — — K = 4
— — — — — —
16S**... 3s13p33d2 — — —
— K = 6
8 О ... 2s22p4 __ — — — K = 2
В отличии от атома серы, атом кислорода возбудить нельзя, так как во втором энергетическом уровне только два подуровня.
Направленность
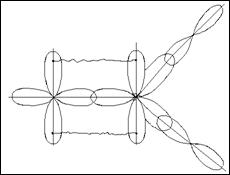
Квантово-механическое объяснение направленности химической связи основано на учете формы различных орбиталей, их перекрывание может осуществляться различными способами и зависит от способа перекрывания и симметрии образующегося электронного облака. Различают б-, p- и ∂- связи.
б-связи образуются при перекрывании электронных облаков вдоль линии соединения атомов.
p-связи образуются при перекрывании электронных облаков по обе стороны от линии, соединяющей центры атомов.
∂-связи образуются при перекрывании всех четырех лопастей d -орбиталей, расположенных в параллельных плоскостях.
s-электроны могут участвовать в образовании только б связей, р-орбитали - в б и p –связывании. Например :
В молекулах с кратными связями одна связь сигма -, остальные - пи.
Геометрические формулы молекул
Рассмотрим строение простейших молекул на примере водородных со-единений элементов VII, VI, V и IV групп главных подгрупп .
HСl H - Сl
Определяем электронные конфигурации атомов
+17Cl0 …3s23p3 





 3p
3p

 K=1
K=1
 3s
3s

 1H 1s1 1s K=1
1H 1s1 1s K=1
молекула имеет линейную форму, угол связи равен 180°.

 2) Н2S Н — S
2) Н2S Н — S
Н









 16S…3s2 3p4 3p К=2
16S…3s2 3p4 3p К=2
3s

 1H 1S1 1S K=
1H 1S1 1S K=
Молекула имеет угловую форму, угол связи равен 900
РН3
Н

3) Н-Р-Н, Р








 15P…3s23p3 3p. 3p К=3
15P…3s23p3 3p. 3p К=3
3s

 1H 1S1 1S K=1
1H 1S1 1S K=1
Угол связи равен 90°, молекула имеет
форму пирамиды.
Гибридизация
Обычно атомы формируют связи за счет электронов разных подуровней. Несмотря на различие формы исходных орбиталей, образованные при этом связи равноценны. Теоретическое обоснование этого факта предложили Слейтер и Полинг. Они показали, что при расчете и истолковании химической связи, образованной разными орбиталями не очень сильно различающимися по энергии, их можно заменить тем же количеством одинаковых орбиталей, называемых гибридными. При гибридизации происходит выравнивание энергии и формы атомных орбиталей. Гибридные орбитали сильно вытянуты в одну сторону от ядра, что обеспечивает их более сильное перекрывание с орбиталями других атомов, а это приводит к образованию более прочной связи. Гибридизации способствует также то обстоятельство, что при гибридизации электроны в многоэлектронных атомах испытывают меньшее отталкивание друг от друга, s- и р –орбитали.
Условиями устойчивой гибридизации являются :
1. Близость энергии орбиталей, участвующих в гибридизации.
2. Достаточно высокая плотность орбиталей.
3. Высокая степень перекрывания электронных облаков.
Исходя из сказанного, склонность к гибридизации с ростом заряда ядра уменьшается и в периодах, и в группах.
Различают sp- , sp2 -, sp3 - гибридизацию.
Рассмотрим примеры различных видов гибридизации:
1) ВеС12 Сl ¾ Ве ¾ Сl

 4Ве...2s2 __ __ __
4Ве...2s2 __ __ __
 2s К=0
2s К=0

 4Ве*...2s12р1 2р ___ К=2
4Ве*...2s12р1 2р ___ К=2
 2s ___
2s ___
 sр-гибридизация
sр-гибридизация


17Cl…3s23p5 3p
 |
3s
К=1
 Молекула имеет линейную форму,
Молекула имеет линейную форму,
угол связи равен 180
 2) ВCI3 Сl - В - Сl
2) ВCI3 Сl - В - Сl
Cl
 5В...2s22рI 2р ___ ___ ___
5В...2s22рI 2р ___ ___ ___
К=1

 2s ___
2s ___


 5В*… 2s12p2 2р ___ ___ ___ К=3
5В*… 2s12p2 2р ___ ___ ___ К=3
2s —
sр2 –гибридизация
Молекула имеет форму плоского треугольника, угол связи равен 120°
Н
 |
3) 
 СН4 Н С Н
СН4 Н С Н

Н

 6С…2s22р2 2р ___ ___ ___ K=2
6С…2s22р2 2р ___ ___ ___ K=2

 2 ___
2 ___
6С*…2s12p3


 2p ___ ___ ___ К=4
2p ___ ___ ___ К=4

2s ___
sр3 -гибридизация
Молекула имеет тетраэдрическую форму,
угол связи равен 1090 28/
Очень часто углы в молекулах не равны тем, которые мы рассматривали выше, это связано с тем , что на геометрическую форму молекул влияют несвязывающие электронные пары. Рассмотрим графические формулы молекул аммиака и воды.
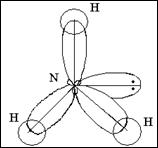
. . Молекула
NН3 Н-N -Н пирамидальная
½
H






 7N …2s22p3 2p
7N …2s22p3 2p


 2s
2s
Н2О Н ¾ O :
½
H 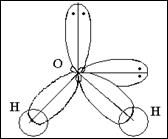
. .









 8O …2s22p4 2p
8O …2s22p4 2p
2s
молекула угловая
ГЕОМЕТРИЧЕСКИЕ ФОРМЫ МОЛЕКУЛ С КРАТНЫМИ СВЯЗЯМИ
При определении геометрической формы таких молекул учитывают, что p-связи образуются только «чистыми» р-орбиталями, в этом случае образуются совмещённые конфигурации.
Например: COCl2
 Cl
Cl
O=С
 Cl
Cl

 6С… 2s22p2 2p __ __ __
6С… 2s22p2 2p __ __ __
 K=2
K=2
 2S ___
2S ___


 6C*…2s1p3 2p __ __ __
6C*…2s1p3 2p __ __ __
K=4
 2S ___
2S ___
Один из р-электронов образует p-связь, значит атом углерода находится в состоянии sp2 гибридизации. Молекула имеет линейную форму, угол связи равен 180°



 8O...2S2 2р4 2р ___ ____ ____
8O...2S2 2р4 2р ___ ____ ____
К=2
17Cl…3s23p5




 3p ___ ____ ____ K=1
3p ___ ____ ____ K=1

 3s ____
3s ____
Молекула имеет плоскую треугольную форму.
ПРИНЦИП ГИЛЛЕСПИ
Очень простой способ предсказания валентных углов был разработан Гиллеспи. В основе способа лежит модель отталкивания локализованных электронных пар. Для молекул и ионов с большей атомностью число осей симметрии можно определить по формуле :
n=n2e – nп ,
где n-число осей симметрии центрального атома;
n2e - число электронных пар у центрального атома;
nп, число Пи-связей у центрального атома. Например : Н2SO4


 Н — O O n = 6-2=4 форма молекулы тетраэдрическая
Н — O O n = 6-2=4 форма молекулы тетраэдрическая


 S
S
Н — O O
Поляризуемость
Связь между атомами различных элементов всегда более или менее полярна. Для характеристики реакционной способности молекул необходимо знать не только исходное распределение плотности электронных облаков , но и легкость с которой оно изменяется. Мерой последней является поляризуе-мость. Поляризуемость -это способность связи становится полярной под действием внешнего поля.
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Термодинамика базируется на трех законах, из которых все остальные положения данной науки можно получить путем логических рассуждений.
Первый закон термодинамики непосредственно связан с законом сохранения энергии. Он позволяет рассчитывать тепловые балансы различных процессов, в том числе и химических реакций.
Существует несколько формулировок 1–го закона термодинамики, например:
Ø Разные формы энергии переходят друг в друга в строго эквивалентных количествах.
Ø Внутренняя энергия является функцией состояния, т. е. ее изменение не зависит от пути процесса, а зависит только от начального и конечного состояния системы.
Ø Вечный двигатель первого рода невозможен.
Вечный двигатель первого рода – воображаемая машина, которая, будучи раз пущена в ход, совершала бы работу неограниченно долгое время, не потребляя энергии извне.
Вечный двигатель второго рода – воображаемая периодически действующая машина, которая целиком превращала бы теплоту, передаваемую ей окружающими телами, в работу.
При v=const вся теплота, подведенная к системе, расходуется на увеличение ее внутренней энергии, т. е. тепловой эффект химической реакции равен изменению внутренней энергии.
Тепловой эффект химической реакции при p=const равен энтальпии.
Энтальпия – функция состояния термодинамической системы, равная сумме внутренней энергии системы и произведения давления ее на объем; изменение энтальпии в изобарном процессе равно тепловому эффекту.
Связь между тепловыми эффектами при p=const или v=const описывается уравнением:
| DH = DU + PDV. | (1) |
С учетом уравнения состояния идеального газа для
