Органические соединения. полимеры
Полимер – вещество, состоящее из молекул, характеризующихся многократным повторением одного или более типов атомов или групп атомов (структурных звеньев), соединенных между собой ковалентными химическими связями в количестве, достаточном для проявления комплекса свойств, которые остаются практически неизменными и при добавлении или удалении одного или нескольких структурных звеньев.
Большую часть полимеров составляют органические полимеры. Если цепь макромолекулы полимера состоит только из атомов углерода, то его называют карбоцепным, например полиэтилен: -(СН2-СН2)n-, где n – степень полимеризации, т. е. число повторяющихся структурных звеньев цепи полимера. При этом в составе боковых групп этих соединений могут находиться атомы водорода, кислорода, азота и серы.
Если основная цепь полимера состоит из атомов углерода и кислорода, углерода и азота, углерода и серы, то такой полимер называют гетерогенным, например полиамиды: 
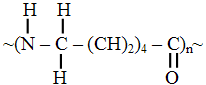 .
.
Цепь элементорганических полимеров состоит из атомов кремния, фосфора и др., к которым присоединены углеродные атомы или группы, например силоксан:
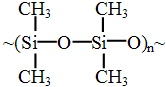 .
.
В отличие от органических полимеров в цепях и боковых группах неорганических полимеров атомы углерода отсутствуют. Примером таких полимеров может служить кремниевая кислота
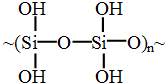 .
.
Цепная молекула полимера называется макромолекулой. Составляющие ее низкомолекулярные повторяющиеся структурные единицы (или звенья) образованы низкомолекулярными веществами, способными к многократному соединению друг с другом в результате химических реакций синтеза. Эти вещества называются мономерами.
Если полимер содержит в основной цепи молекулы двух или более мономеров, то он является сополимером, например бутадиен-стирольный сополимер:
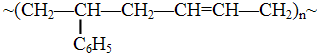 .
.
В зависимости от строения основной цепи макромолекулы подразделяются на линейные, разветвленные и сшитые (сетчатые) (рис. 2).
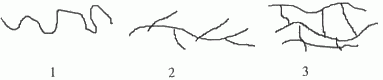
Рис. 2. Схематичное изображение различных видов макромолекул:
1 – линейные; 2 – разветвленные; 3 – сшитые (сетчатые)
Полимеры получают синтезом из низкомолекулярных соединений – мономеров методом полимеризации или методом поликонденсации.
Полимеризацией называют цепную реакцию, в ходе которой молекулы мономера последовательно присоединяются к активному центру, находящемуся на конце растущей цепи.
Поликонденсацией называют процесс образования полимеров из би- или полифункциональных мономеров, сопровождающийся выделением побочных низкомолекулярных соединений.
Важнейшие представители полимеров в качестве примера приведены в табл. 10 приложения.
Контрольные задания
661. Какая общая формула выражает состав ацетиленовых углеводородов (алкинов)? Как из метана получить ацетилен, затем винилацетилен, а из последнего хлоропрен?
662. Напишите структурную формулу простейшей непредельной одноосновной карбоновой кислоты и уравнение реакции взаимодействия этой кислоты с метиловым спиртом. Составьте схему полимеризации образовавшегося продукта.
663. Как из карбида кальция и воды получить винилацетат, применив реакцию Кучерова? Напишите уравнения реакций. Составьте схему полимеризации винилацетата.
664. Напишите схему строения синтетического каучука, полученного из 2,3-диметилбутадиена, считая, что он представляет собой продукт 1,4-полимеризации.
665. Какой путь получения синтетического каучука разработал С.В. Лебедев? Приведите уравнения реакций.
666. Какие соединения называют аминами? Составьте схему поликонденсации адипиновой кислоты и гексаметилендиамина. Назовите образовавшийся полимер.
667. Как можно получить винилхлорид, имея в распоряжении карбид кальция, хлорид натрия, серную кислоту и воду? Напишите уравнения соответствующих реакций. Составьте схему полимеризации винилхлорида.
668. Полимером какого непредельного углеводорода является натуральный каучук? Напишите структурную формулу этого углеводорода. Как называют процесс превращения каучука в резину? Чем по строению и свойствам различаются каучук и резина?
669. Напишите схему строения бутадиен-стирольного каучука, считая для простоты, что он представляет собой регулярный полимер, в котором на одно стирольное звено приходится три бутадиеновых, и что бутадиен реагирует только в положениях 1,4.
670. Что такое хлоропреновый каучук? Как синтезировать необходимый для его получения мономер?
671. Рассчитайте содержание хлора (%) в хлоропреновом каучуке.
672.Напишите уравнения реакций получения ацетилена, превращения ацетилена в ароматический углеводород. При взаимодействии какого вещества с ацетиленом образуется акрилонитрил? Составьте схему полимеризации акрилонитрила.
673. Напишите структурную формулу метакриловой кислоты. Какое соединение получается при взаимодействии её с метиловым спиртом? Напишите уравнение реакции. Составьте схему полимеризации образующегося продукта.
674. Какие углеводороды называются диеновыми? Приведите пример. Какой общей формулой выражают состав диеновых углеводородов? Составьте схему полимеризации одного из диеновых углеводородов.
675. Приведите примеры высокомолекулярных соединений, относящихся к полиолефинам. Напишите их структурные формулы.
676. Напишите схему образования димера и тримера изобутилена под действием серной кислоты с учетом механизма этой реакции.
677. Какие соединения называются олефинами? Приведите их общую формулу и схему полимеризации одного из них.
678. Какой общей формулой выражают состав этиленовых углеводородов? Какие химические реакции наиболее характерны для них? Что такое полимеризация, поликонденсация? Чем отличаются друг от друга эти реакции?
679. Каковы различия в свойствах предельных и непредельных углеводородов? Составьте схему образования каучука из дивинила и стирола. Что такое вулканизация?
680. Какие соединения называют аминокислотами? Напишите формулу простейшей аминокислоты. Составьте схему поликонденсации аминокапроновой кислоты. Как называется образующийся при этом полимер?
681. Напишите схему строения сополимера стирола с акрилонитрилом, считая, что образуется полимер с регулярным чередованием мономерных (структурных) звеньев (соотношение мономеров 1:1).
682. Какие соединения называют альдегидами? Какое свойство альдегидов лежит в основе реакции серебряного зеркала? Что такое формалин? Составьте схему получения фенолформальдегидной смолы.
683. Напишите уравнение реакции полимеризации формальдегида и определите степень полимеризации в реакции получения полиформальдегида со средней молекулярной массой 45000.
684. Составьте уравнения реакций получения полихлорвинила, если в качестве исходного вещества взять ацетилен.
685. Как называют углеводороды, представителем которых является изопрен? Составьте схему сополимеризации изопрена и изобутилена.
686. Какие соединения называют элементорганическими, кремнийорганическими? Укажите важнейшие свойства кремнийорганических полимеров. Как влияет на свойства кремнийорганических полимеров увеличение числа органических радикалов, связанных с атомами кремния?
687. Какие соединения называют диолефинами? Составьте схему полимеризации одного из диолефинов. Укажите три состояния линейных полимеров. Чем характеризуется переход из одного состояния в другое?
688. Напишите реакцию получения органического стекла (полиметилметакрилата), опишите его свойства и применение.
689. Как получают волокно нитрон? Напишите схемы соответствующих реакций.
690. Напишите уравнения реакции дегидратации пропилового спирта. Составьте схему полимеризации полученного углеводорода.
691. Какие полимеры называют стереорегулярными? Чем объясняется более высокая температура плавления и большая механическая прочность стереорегулярных полимеров по сравнению с нерегулярными полимерами?
692. Как получают в промышленности стирол? Приведите схему его полимеризации. Изобразите при помощи схем линейную, трехмерную структуры полимеров.
693. Напишите реакцию получения поливинилацетата, опишите его свойства и применение.
694. Напишите схему образования продуктов поликонденсации фенола с уксусным альдегидом.
695. Напишите уравнения реакции полимеризации изомеров бутилена, структура которых выражается формулами СН2=СН-СН2-СН3 и СН3-СН=СН-СН3.
696. Составьте уравнение реакции получения изопренового каучука полимеризацией изопрена.
697. Какие полимеры называются термопластичными, термореактивными? Приведите примеры.
698. Охарактеризуйте отличие в строении целлюлозы и крахмала. Приведите формулы.
699.Напишите реакцию получения нейлона, опишите его свойства и применение.
700. Напишите реакцию получения полиуретана, опишите его свойства и применение.
ПРИЛОЖЕНИЯ
Таблица 3
Названия важнейших кислот и их средних солей
| Кислота | Название | |
| кислоты | соли | |
| HAlO2 | Метаалюминиевая | Метаалюминат |
| H3AsO4 | Мышьяковая | Арсенат |
| H3AsO3 | Мышьяковистая | Арсенит |
| HBO2 | Метаборная | Метаборат |
| H3BO3 | Ортоборная | Ортоборат |
| H2B4O7 | Четырехборная | Тетраборат |
| HBr | Бромоводородная | Бромид |
| HCOOH | Муравьиная | Формиат |
| CH3COOH | Уксусная | Ацетат |
| HCN | Циановодородная (синильная кислота) | Цианид |
| H2CO3 | Угольная | Карбонат |
| H2C2O4 | Щавелевая | Оксалат |
| HCl | Хлороводородная (соляная кислота) | Хлорид |
| HClO | Хлорноватистая | Гипохлорит |
| HClO2 | Хлористая | Хлорит |
| HClO3 | Хлорноватая | Хлорат |
| HClO4 | Хлорная | Перхлорат |
| HCrO2 | Метахромистая | Метахромит |
| H2CrO4 | Хромовая | Хромат |
| H2Cr2O7 | Двухромовая | Дихромат |
| HI | Иодоводородная | Иодид |
| HIO4 | Иодная | Периодат |
| HMnO4 | Марганцовая | Перманганат |
| NH3 | Азидоводород (азотистоводородная) | Азид |
| HNO2 | Азотистая | Нитрит |
| HNO3 | Азотная | Нитрат |
| HPO3 | Метафосфорная | Метафосфат |
| H3PO4 | Ортофосфорная | Ортофосфат |
| H4P2O7 | Двуфосфорная | Дифосфат |
| HF | Фтороводородная (плавиковая кислота) | Фторид |
| H2S | Сероводородная | Сульфид |
| HSCN | Родановодородная | Роданид |
| H2SO3 | Сернистая | Сульфит |
| H2SO4 | Серная | Сульфат |
| H2S2O7 | Двусерная | Дисульфат |
| H2SiO3 | Кремниевая | Силикат |
Таблица 4
Термодинамические константы веществ
| Вещество | Фазовое состояние | ΔН  , кДж/моль , кДж/моль | S  , Дж/моль∙К , Дж/моль∙К | ΔG  , кДж/моль , кДж/моль |
| Cl2 | Г | 222,95 | ||
| O2 | Г | 205,03 | ||
| N2 | Г | 191,49 | ||
| H2 | Г | 130,59 | ||
| CS2 | Г | 115,28 | 237,8 | 65,9 |
| C6H6 | Г | 82,93 | 269,2 | 129,7 |
| H2S | Г | -20,15 | 206,64 | -33,8 |
| NH3 | Г | -46,19 | 192,50 | -16,71 |
| HCl | Г | -92,31 | 186,68 | -94,79 |
| CO | Г | -110,52 | 197,91 | -137,27 |
| H2O | Г | -241,83 | 188,72 | -228,59 |
| NO2 | Г | 33,0 | 240,46 | 51,84 |
| NO | Г | 90,37 | 210,2 | 86,59 |
| CO2 | Г | -393,51 | 213,65 | -394,38 |
| CH3OH | Г | -201,17 | - | - |
| C2H5OH | Г | -235,31 | 282,4 | -168,1 |
| PCl3 | Г | -287,02 | 311,66 | -260,5 |
| PCl5 | Г | -366,0 | 352,71 | -305,4 |
| C2H2 | Г | 228,75 | 200,82 | 209,20 |
| CH4 | Г | -74,85 | 186,19 | -50,79 |
| C2H6 | Г | -84,67 | 229,5 | -32,9 |
| C2H4 | Г | 52,28 | 219,45 | 68,1 |
| CH3OH | Ж | -484,1 | 126,8 | -389,4 |
| H2O | Ж | -285,84 | 69,94 | -237,19 |
| C | алмаз | 1,828 | 2,44 | 2,833 |
| C | графит | 5,69 | ||
| Fe | Т | 27,2 | ||
| Ti | Т | 30,7 | ||
| S | ромб | 31,9 | ||
| TiO2 | Т | -943,9 | 50,3 | -888,6 |
| FeO | Т | -264,8 | 54,0 | -244,3 |
| NH4Cl | Т | -316,39 | 95,8 | -203,2 |
Окончание табл.4
| Fe2O3 | Т | -822,10 | 87,4 | -740,3 |
| Ca(OH)2 | Т | -988,50 | 76,1 | -896,8 |
| Al2O3 | Т | -1669,80 | 50,92 | -1582,0 |
| BaCO3 | Т | -1219,0 | 112,0 | -1138,8 |
| CaCO3 | Т | -1206,9 | 92,9 | -1128,75 |
| Fe3O4 | Т | -1117,0 | 146,4 | -1014,2 |
| BeCO3 | Т | -982,0 | 67,29 | -944,75 |
| CaO | Т | -635,5 | 39,7 | -604,2 |
| BeO | Т | -598,0 | 14,1 | -581,61 |
| BaO | Т | -558,1 | 70,3 | -528,4 |
| NaCl | Т | -411,1 | 72,12 | -384,03 |
| ZnO | Т | -350,6 | 43,64 | -318,2 |
| PbO2 | Т | -276,6 | 74,89 | -219,0 |
| PbO | Т | -219,3 | 66,2 | -189,1 |
| Pb | Т | 64,8 | ||
| SO2 | Г | -296,9 | 248,1 | -300,2 |
| NH4NO3 | Т | -365,4 | 151,0 | -183,8 |
| SO3 | Г | -396,1 | 256,4 | -370,0 |
Таблица 5
Стандартные электродные потенциалы φ0 металлов в водных
растворах
| Электрод | Электродная реакция | φ0, В |
| Li/Li+ | Li+ + ē = Li | -3,05 |
| K/K+ | K+ + ē = K | -2,93 |
| Cs+/Cs | Cs+ + ē = Cs | -2,92 |
| Ra2+/Ra | Ra2+ + 2ē = Ra | -2,91 |
| Ba2+/Ba | Ba2+ + 2ē = Ba | -2,90 |
| Ca2+/Ca | Ca2+ + 2ē = Ca | -2,87 |
| Na+/Na | Na+ + ē = Na | -2,71 |
| La3+/La | La3+ + 3ē = La | -2,52 |
| Mg2+/Mg | Mg2+ + 2ē = Mg | -2,36 |
| Be2+/Be | Be2+ + 2ē = Be | -1,85 |
Окончание табл. 5
| Al3+/Al | Al3+ + 3ē = Al | -1,66 |
| Ti2+/Ti | Ti2+ + 2ē = Ti | -1,63 |
| V2+/V | V2+ + 2ē = V | -1,19 |
| Mn2+/Mn | Mn2+ + 2ē = Mn | -1,18 |
| Cr2+/Cr | Cr2+ + 2ē = Cr | -0,91 |
| Zn2+/Zn | Zn2+ + 2ē = Zn | -0,76 |
| Cr3+/Cr | Cr3+ + 3ē = Cr | -0,74 |
| Fe2+/Fe | Fe2+ + 2ē = Fe | -0,44 |
| Cd2+/Cd | Cd2+ + 2ē = Cd | -0,40 |
| Co2+/Co | Co2+ + 2ē = Co | -0,28 |
| Ni2+/Ni | Ni2+ + 2ē = Ni | -0,25 |
| Mo3+/Mo | Mo3+ + 3ē = Mo | -0,20 |
| Sn2+/Sn | Sn2+ + 2ē = Sn | -0,14 |
| Pb2+/Pb | Pb2+ + 2ē = Pb | -0,13 |
| W3+/W | W3+ + 3ē = W | -0,05 |
| Fe3+/Fe | Fe3+ + 3ē = Fe | -0,04 |
| 2H+/H2 | 2H+ + 2ē = H2 | 0,00 |
| Ge2+/Ge | Ge2+ + 2ē = Ge | +0,01 |
| Sb3+/Sb | Sb3+ + 3ē = Sb | +0,20 |
| Bi3+/Bi | Bi3+ + 3ē = Bi | +0,23 |
| Cu2+Cu | Cu2+ + 2ē = Cu | +0,34 |
| Cu+/Cu | Cu+ + ē = Cu | +0,52 |
| Ag+/Ag | Ag+ + ē = Ag | +0,80 |
| Hg2+/Hg | Hg2+ + 2ē = Hg | +0,85 |
| Pd2+/Pd | Pd2+ + 2ē = Pd | +0,99 |
| Pt2+/Pt | Pt2+ + 2ē = Pt | +1,20 |
| Au3+/Au | Au3+ + 3ē = Au | +1,50 |
| Au+/Au | Au+ + ē = Au | +1,70 |
Таблица 6
Константы диссоциации некоторых кислот и оснований
| Электролит | Формула | К |
| КИСЛОТЫ | ||
| Азотистая кислота | HNO2 | 4∙10-4 |
| Азотная кислота | HNO3 | 4,36∙10 |
| Борная кислота | Н3ВО3 | (I) 5,8∙10-10 (II) 1,8∙10-13 (III) 1,6∙10-10 |
| Бромноватистая кислота | HBrO | 2,1∙10-9 |
| Бромоводород | HBr | 1∙109 |
| Вода | Н2О | 1,8∙10-16 |
| Йодоводород | HI | 1∙1011 |
| Кремниевая кислота | H2SiO3 | (I) 2,2∙10-10 (II) 1,6∙10-12 |
| Муравьиная кислота | HCOOH | 1,8∙10-4 |
| Селенистая кислота | H2SеO3 | (I) 3,5∙10-3 (II) 5,0∙10-8 |
| Селеноводород | H2Sе | (I) 1,7∙10-4 (II) 1,0∙10-11 |
| Серная кислота | H2SO4 | (I) 1∙103 (II) 1,2∙10-2 |
| Сернистая кислота | H2SO3 | (I) 1,6∙10-2 (II) 6,3∙10-8 |
| Сероводород | H2S | (I) 6,0∙10-8 (II) 1,0∙10-14 |
| Теллуристая кислота | Н2ТеО3 | (I) 3,0∙10-3 (II) 2,0∙10-8 |
| Теллуроводород | Н2Те | (I) 1,0∙10-3 (II) 1,0∙10-11 |
| Угольная кислота | Н2СО3 | (I) 4,5∙10-7 (II) 4,7∙10-11 |
| Уксусная кислота | СН3СООН | 1,8∙10-5 |
| Хлорноватистая кислота | HOCl | 5,0∙10-8 |
| Хлороводород (соляная кислота) | HCl | 1,0∙107 |
| Хлоруксусная кислота | CH2ClCOOH | 1,4∙10-3 |
Окончание табл. 6
| Фосфорная кислота | Н3РО4 | (I) 7,5∙10-3 (II) 6,3∙10-8 (III) 1,3∙10-12 |
| Фтороводород (плавиковая кислота) | HF | 6,6∙10-4 |
| Циановодород | HCN | 7,9∙10-10 |
| Хромовая | H2CrO4 | (I) 1∙10 (II) 3,6∙10-7 |
| Щавелевая кислота | Н2С2О4 | (I) 5,4∙10-2 (II) 5,4∙10-5 |
| ОСНОВАНИЯ | ||
| Гидроксид алюминия | Al(OH)3 | (III) 1,38∙10-9 |
| Гидроксид аамония | NH4OH | 1,79∙10-5 |
| бария | Ba(OH)2 | (II) 2,3∙10-1 |
| железа (II) | Fe(OH)2 | (II) 1,3∙10-4 |
| железа (III) | Fe(OH)3 | (II) 1,82∙10-11 (III)1,35∙10-12 |
| лития | LiOH | 8,75∙10-1 |
| магния | Mg(OH)2 | (II) 2,5∙10-3 |
| марганца | Mn(OH)2 | (II) 5∙10-4 |
| меди (II) | Cu(OH)2 | (II) 3,4∙10-7 |
| натрия | NaOH | 5,9 |
| свинца (II) | Pb(OH)2 | (II) 9,6∙10-4 |
| стронция | Sr(OH)2 | (II) 1,5∙10-1 |
| хрома (III) | Cr(OH)3 | (III)1,01∙10-10 |
| цинка | Zn(OH)2 | (II) 4∙10-5 |
Таблица 7
Произведения растворимости некоторых труднорастворимых
электролитов (250С)
| Электролит | ПР | Электролит | ПР |
| AgBr | 5,3∙10-13 | Fe(OH)2 | 5,0∙10-16 |
| Ag2CO3 | 8,2∙10-12 | Fe(OH)3 | 4,0∙10-38 |
| AgCl | 1,8∙10-10 | FePO4 | 1,3∙10-22 |
| Ag2CrO4 | 1,1∙10-12 | FeS | 5,0∙10-18 |
| AgI | 8,3∙10-17 | HgS | 1,6∙10-52 |
| Ag2S | 6,3∙10-50 | MgCO3 | 4,0∙10-52 |
| Ag2SO4 | 1,6∙10-5 | Mg(OH)2 | 5,0∙10-12 |
| Ag3PO4 | 1,3∙10-20 | Mg3(PO4)2 | 1,0∙10-13 |
| Al(OH)3 | 5,0∙10-33 | MnCO3 | 1,8∙10-11 |
| AlPO4 | 5,7∙10-19 | Mn(OH)2 | 4,0∙10-14 |
| BaCO3 | 5,1∙10-9 | MnS | 2,5∙10-10 |
| BaCrO4 | 1,2∙10-10 | Ni(OH)2 | 2,0∙10-6 |
| BaSO4 | 1,1∙10-10 | PbBr2 | 9,1∙10-6 |
| Ba3(PO4)2 | 6,0∙10-39 | PbCO3 | 7,5∙10-14 |
| BeCO3 | 1,0∙10-3 | PbCl2 | 1,56∙10-5 |
| CaCO3 | 4,8∙10-9 | PbF2 | 2,7∙10-8 |
| CaF2 | 4,0∙10-11 | PbI2 | 1,1∙10-9 |
| CaHPO4 | 2,7∙10-7 | PbS | 2,5∙10-27 |
| Ca(H2PO4)2 | 1,0∙10-3 | PbSO4 | 1,6∙10-8 |
| CaSO4 | 9,1∙10-8 | Pb3(PO4)2 | 7,9∙10-43 |
| Ca3(PO4)2 | 2,0∙10-29 | Sb2S3 | 1,6∙10-93 |
| CdS | 7,9∙10-27 | SrCO3 | 1,1∙10-10 |
| CoCO3 | 1,4∙10-13 | SrCrO4 | 3,6∙10-5 |
| Co(OH)2 | 2,0∙10-25 | SrF2 | 2,5∙10-9 |
| α-CoS | 4,0∙10-21 | SrSO4 | 3,2∙10-7 |
| β-CoS | 2,0∙10-25 | ZnCO3 | 1,4∙10-14 |
| CrPO4 | 1,0∙10-17 | Zn(OH)2 | 5,0∙10-17 |
| CuCO3 | 1,6∙10-19 | α-ZnS | 1,6∙10-24 |
| Cu(OH)2 | 1,6∙10-19 | β-ZnS | 2,5∙10-22 |
| CuS | 6,3∙10-36 | Zn3(PO4)2 | 9,1∙10-33 |
Таблица 8
Относительные электроотрицательности элементов (по Полингу)
| I | II | III | IV | V | VI | VII | VIII | ||||
| H 2,1 | He - | ||||||||||
| Li 0,97 | Be 1,47 | B 2,01 | C 2,50 | N 3,07 | O 3,50 | F 4,10 | Ne - | ||||
| Na 1,01 | Mg 1,23 | Al 1,47 | Si 1,74 | P 2,1 | S 2,5 | Cl 2,83 | Ar - | ||||
| K 0,91 | Ca 1,04 | Sc 1,20 | Ti 1,32 | V 1,45 | Cr 1,56 | Mn 1,60 | Fe 1,64 | Co 1,70 | Ni 1,75 | ||
| Cu 1,75 | Zn 1,66 | Ga 1,82 | Ge 2,02 | As 2,20 | Se 2,48 | Br 2,74 | Kr - | ||||
| Rb 0,89 | Sr 0,99 | Y 1,11 | Zr 1,22 | Nb 1,23 | Mo 1,30 | Te 1,36 | Ru 1,42 | Rh 1,45 | Pd 1,35 | ||
| Ag 1,42 | Cd 1,46 | In 1,49 | Sn 1,72 | Sb 1,82 | Tc 2,01 | I 2,21 | Xe - | ||||
| Cs 0,86 | Ba 0,97 | La* 1,08 | Hf 1,23 | Ta 1,33 | W 1,40 | Re 1,46 | Os 1,52 | Ir 1,55 | Pt 1,44 | ||
| Au 1,42 | Hg 1,44 | Tl 1,44 | Pb 1,55 | Bi 1,67 | Po 1,76 | At 1,90 | Rn - | ||||
| Fr 0,86 | Ra 0,97 | Ac** 1,00 |
*Лантаноиды: 1,08 – 1,14
**Актиноиды: 1,11 – 1,20
Таблица 9
| Квантовый | Магнитное квантовое число ml | Число квантовых состояний (орбиталей) | Максимальное число электронов | |||||
| уровень | подуровень | В подуровне (2l + 1) | В уровне на n2 | В подуровне (2l + 1) | В уровне на 2n2 | |||
| Обозначение | Главное квантовое число n | Обозначение | Орбитальное квантовое число l | |||||
| K | S | |||||||
| L | S | |||||||
| P | -1; 0; +1 | |||||||
| M | S | |||||||
| P | -1; 0; +1 | |||||||
| d | -2;-1; 0; +1;+2 | |||||||
| N | S | |||||||
| P | -1; 0; +1 | |||||||
| d | -2;-1; 0; +1;+2 | |||||||
| f | -3;-2;-1;0;+1;+2;+3 |
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
ОСНОВНАЯ
1. Ахметов, Н.С. Общая и неорганическая химия: учеб. для вузов / Н. С. Ахметов. - 7-е изд., стер. - М.: Высш. шк., 2008.
2. Глинка, Н.Л. Задачи и упражнения по общей химии : учеб. пособие / Н. Л. Глинка ; под ред. В. А. Рабиновича, Х. М. Рубиной. - М.: Интеграл-Пресс, 2008.
3. Глинка,Н.Л. Общая химия: учеб. пособие для вузов / Н. Л. Глинка; под ред. А. И. Ермакова. - 13-е изд., испр. - М.: Интеграл-Пресс, 2003. -
4. Коровин, Н.В. Общая химия: учеб. для вузов / Н. В. Коровин. - М.: Высш. шк., 2009.
5. Лидин Р.А. Общая и неорганическая химия в вопросах: учеб. пособие для вузов / Р. А. Лидин, Л. Ю. Аликберова, Г. П. Логинова. - 3-е изд., стер. - М.: Дрофа, 2005.
ДОПОЛНИТЕЛЬНАЯ
1. Гуров, А.А. Химия. учеб для втузов / А.А. Гуров, Ф.З. Бадаев, Л.П. Овчаренко, В.Н. Шаповал. – М.: Изд-во МГТУ им. Н.Э. Баумана, 2008.
2. Лидин, Р.А. Химические свойства неорганических веществ: учеб. пособие для вузов / Р. А. Лидин, В. А. Молочко, Л. Л. Андреева; под ред. Р. А. Лидина. - 4-е изд., стер. - М. : КолосС, 2003.
3. Неорганическая химия: учеб. для вузов : В 3 т. Т. 3, кн. 2 : Химия переходных элементов / А. А. Дроздов (и др.); под ред. Ю. Д. Третьякова. - 2-е изд., испр. - М. : Академия, 2008.
4. Сборник задач и упражнений по общей и неорганической химии: учеб. пособие для вузов / Н. Н. Павлов [и др.]; под ред. Н. Н. Павлова. - М.: Дрофа, 2005
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Вольхин, В.В. Общая химия. Основной курс: учеб. пособие для вузов / В. В. Вольхин. - 2-е изд., перераб. и доп. - СПб. [и др.]: Лань, 2008.
2. Гельфман, М.И. Химия : учеб. для вузов / М. И. Гельфман, В. П. Юстратов. - 4-е изд., стер. - СПб. [и др.]: Лань, 2008.
3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: учеб. пособие / З.Е. Гольбрайх, Е.И. Маслов. – М.: АСТ Астрель, 2004.
4 Горбунов, А.И. Химия: учеб. пособие для втузов / А. И. Горбунов, Г. Г. Филиппов, В. И. Федин. - М.: Изд-во МГТУ им. Н. Э. Баумана, 2007.
5. Елфимов, В.И. Основы общей химии: учеб. пособие / В. И. Елфимов, А. И. Бережной. - М.: Высш. шк., 2009.
6. Задачи предлабораторного контроля по химии: учеб.-метод. пособие / [сост. Г. А. Бурак и др.]. - Минск: Изд-во БНТУ, 2005.
7. Князев, Д.А. Неорганическая химия : учеб. пособие для вузов / Д. А. Князев, С. Н. Смарыгин. - 2-е изд., перераб. и доп. - М.: Дрофа, 2004.
8. Коржуков, Н.Г. Общая и неорганическая химия / Н.Г. Коржуков. – М.: Миссис, 2004.
9. Кудряшов, И.В. Сборник примеров и задач по физической химии: учеб. пособие для вузов / И. В. Кудряшов, Г. С. Каретников. - 7-е изд., стер. - М.: Альянс, 2008.
10. Практикум по общей и неорганической химии: учеб. пособие для вузов / В. И. Фролов [и др.]; под ред. Н. Н. Павлова, В. И. Фролова . - 2-е изд., перераб. и доп. - М. : Дрофа, 2002.
| 11. Пузаков, С.А. Сборник задач и упражнений по общей химии / С.А. Пузаков, В.А. Попков, А.А. Филиппова. – М.: Высшая школа, 2008. 12. Суворов, А.В. Общая химия : учеб. для вузов / А. В. Суворов, А. Б. Никольский. - 5-е изд., испр. - М. : Химиздат, 2007. | ||||
13. Травень В.Ф.Органическая химия : учеб. для вузов : в 2 т. / В. Ф. Травень. - М.: Академкнига, 2008. – Т.2.
| ||||

 Учебно-практическое издание УДОВЕНКО ЕЛЕНА ВАСИЛЬЕВНА ИЛЬИНА ИРИНА ВАСИЛЬЕВНА КАЗАКОВ ОЛЕГ ГРИГОРЬЕВИЧ ОБЩАЯ ХИМИЯ: СБОРНИК КОНТРОЛЬНЫХ ЗАДАНИЙ Редактор издательства Т.Н. Королева Компьютерный набор Е.В. Удовенко Темплан 2010г., п.45 Подписано в печать 15.09.10. Формат 60х84 1/16. Бумага офсетная. Офсетная печать. Усл. печ.л. 10,46. Уч.-изд.л. 10,46. Тираж 140 экз. Заказ . Издательство Брянского государственного технического университета 241035, г. Брянск, бульвар им. 50-летия Октября, 7, тел. 58-82-49. Лаборатория оперативной полиграфии БГТУ, ул. Институтская, 16.
Учебно-практическое издание УДОВЕНКО ЕЛЕНА ВАСИЛЬЕВНА ИЛЬИНА ИРИНА ВАСИЛЬЕВНА КАЗАКОВ ОЛЕГ ГРИГОРЬЕВИЧ ОБЩАЯ ХИМИЯ: СБОРНИК КОНТРОЛЬНЫХ ЗАДАНИЙ Редактор издательства Т.Н. Королева Компьютерный набор Е.В. Удовенко Темплан 2010г., п.45 Подписано в печать 15.09.10. Формат 60х84 1/16. Бумага офсетная. Офсетная печать. Усл. печ.л. 10,46. Уч.-изд.л. 10,46. Тираж 140 экз. Заказ . Издательство Брянского государственного технического университета 241035, г. Брянск, бульвар им. 50-летия Октября, 7, тел. 58-82-49. Лаборатория оперативной полиграфии БГТУ, ул. Институтская, 16.