Опыт 1. Измерение равновесного электродного потенциала металла
Преподаватель выдает студенту два металлических электрода. Студент составляет два гальванических элемента, состоящих из электрода сравнения и исследуемого металлического электрода. В один стакан следует налить раствор соли, катион которой соответствует металлическому электроду (если выдан цинковый электрод, то следует взять водорастворимую соль цинка, например, ZnSO4). В этот же стакан поместить металлический электрод, очищенный наждачной бумагой, промытый дистиллированной водой и просушенный фильтровальной бумагой.
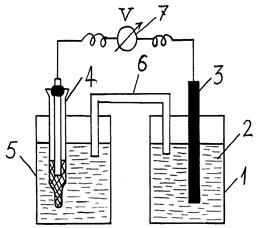
В другой стакан налить насыщенный раствор хлорида калия и поместить в него электрод сравнения (каломельный электрод). Два стакана соединить агар-агаровой трубкой, которая замыкает внутреннюю цепь, являясь проводником ионов. Внешняя цепь замыкается при подключении электрода сравнения и рабочего электрода к цифровому вольтметру. Схема установки представлена на рис. 4.
|
Каломельный электрод можно выразить схемой: 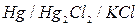 , где
, где 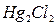 - соль ртути, называемая каломелью.
- соль ртути, называемая каломелью.
Электродная реакция: 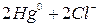 ⇄
⇄ 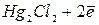 .
.
Общая схема гальванического элемента
Катод (+) 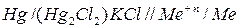 (–) Анод.
(–) Анод.
Слева, как правило, записывается металл, играющий в гальваническом элементе роль катода, а справа - роль анода.
Установка готова для измерения равновесного электродного потенциала металла. Через 3…5 минут следует измерить напряжение с помощью вольтметра (7) (рис. 4) и записать показание прибора в лабораторную тетрадь. Затем отключить прибор, вынуть из раствора металлический электрод (3), снять агар-агаровый мостик (6), и вылить использованный раствор соли (2) из стакана (1) в соответствующий сосуд, где хранится раствор. Электрод сравнения (4), не вынимая из раствора KCl (5) во избежание его порчи, после окончания работ необходимо сдать лаборанту или преподавателю.
Вольтметр показывает значение ЭДС цепи (e). Известно, что
e = jк - jа . (10)
Если потенциал исследуемого металла имеет более положительное значение (jк), чем величина электрода сравнения (jа), то
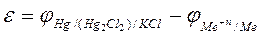 . (11)
. (11)
Из этого уравнения можно рассчитать равновесный потенциал рабочего электрода по формуле
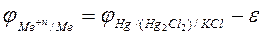 . (12)
. (12)
Для этого необходимо знать равновесный потенциал электрода сравнения (в нашем случае – равновесный потенциал каломельного электрода - 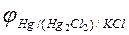 ). Эти данные при различных температурах для насыщенного раствора приведены в табл. 1.
). Эти данные при различных температурах для насыщенного раствора приведены в табл. 1.
Таблица 1
Стандартные величины потенциала каломельного электрода
при температурах от 10 до 29 °С насыщенного раствора
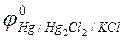
| Температура, 0С | |||||
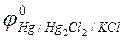 | 0,2536 | 0,2529 | 0,2523 | 0,2516 | 0,2510 |
| Температура, 0С | |||||
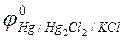 | 0,2503 | 0,2497 | 0,2490 | 0,2483 | 0,2477 |
| Температура, 0С | |||||
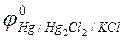 | 0,2471 | 0,2464 | 0,2458 | 0,2451 | 0,2445 |
| Температура, 0С | |||||
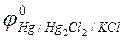 | 0,2438 | 0,2431 | 0,2425 | 0,2418 | 0,2412 |
По уравнению Нернста (1), приведенному в теоретической части лабораторной работы, рассчитывают теоретическое значение равновесного электродного потенциала исследуемого металла. Необходимые данные о стандартных величинах электродных потенциалов исследуемых металлов приведены в табл. 2.
Таблица 2
Стандартные величины электродных потенциалов металлов
в водных растворах при 25°С
| Электрод | Электродная реакция | 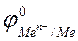 , В , В |
| Li+/Li | Li+ +  = Li = Li | -3,045 |
| Rb+/Rb | Rb+ +  = Rb = Rb | -2,925 |
| K+/K | K+ +  = K = K | -2,925 |
| Cs+/Cs | Cs+ +  = Cs = Cs | -2,923 |
| Ba+2/Ba | Ba+2 + 2  = Ba = Ba | -2,906 |
| Ca+2/Ca | Ca+2 +  = Ca = Ca | -2,866 |
| Na+/Na | Na+ +  = Na = Na | -2,714 |
Продолжение табл. 2
| Mg+2/Mg | Mg+2 + 2  = Mg = Mg | -2,363 |
| Al+3/Al | Al+3 + 3  = Al = Al | -1,662 |
| Ti+2/Ti | Ti+2 + 2  = Ti = Ti | -1,628 |
| Mn+2/Mn | Mn+2 + 2  = Mn = Mn | -1,180 |
| Cr+2/Cr | Cr+2 + 2  = Cr = Cr | -0,913 |
| Zn+2/Zn | Zn+2 + 2  = Zn = Zn | -0,763 |
| Cr+3/Cr | Cr+3 + 3  = Cr = Cr | -0,744 |
| Fe+2/Fe | Fe+2 + 2  = Fe = Fe | -0,440 |
| Cd+2/Cd | Cd+2 + 2  = Cd = Cd | -0,403 |
| Co+2/Co | Co+2 + 2  = Co = Co | -0,277 |
| Ni+2/Ni | Ni+2 + 2  = Ni = Ni | -0,250 |
| Sn+2/Sn | Sn+2 + 2  = Sn = Sn | -0,136 |
| Pb+2/Pb | Pb+2 + 2  = Pb = Pb | -0,126 |
| Fe+3/Fe | Fe+3 + 3  = Fe = Fe | -0,036 |
| 2H+ /H2 | 2H+ + 2  = H2 = H2 | |
| Cu+2/Cu | Cu+2 + 2  = Cu = Cu | +0,337 |
| Cu+/Cu | Cu+ +  = Cu = Cu | +0,521 |
| Ag+/Ag | Ag+ +  = Ag = Ag | +0,799 |
| Hg+2/Hg | Hg+2 + 2  = Hg = Hg | +0,854 |
| Pt+2/Pt | Pt+2 + 2  = Pt = Pt | +1,200 |
| Au+3/Au | Au+3 + 3  = Au = Au | +1,498 |
| Au+/Au | Au+ +  = Au = Au | +1,691 |
Сравните теоретическое и экспериментальное значения потенциалов выданных Вам металлов. Сделайте вывод и объясните, почему измеренная величина потенциала не равна расчетной. Найдите относительную ошибку измерения (П, %) по формуле
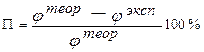 . (13)
. (13)
Полученные данные поместите в табл. 3 и покажите преподавателю.
Таблица 3
Сводная таблица определения электродных потенциалов металлов
| Исследуемый металл | Концентрация иона данного металла в растворе электролита, моль/л | Показание вольтметра, В | Практическое значение равновесного электродного потенциала металла jпр., В | Теоретическое значение электродного потенциала металла jтеор., В | Относительная ошибка измерения, П, % |
