Кипение и кристаллизация растворов
Кипение жидкости наступает, когда давление насыщенных паров становится равным внешнему давлению. Растворенное вещество понижает давление насыщенного пара растворителя над раствором. Это приводит к повышению температуры кипения раствора по сравнению с чистым растворителем. Величина изменения температуры кипения зависит только от концентрации частиц растворенного вещества, и не зависит от их природы. На диаграмме состояния (рис.3.4) для раствора концентрации С понижению давления насыщенных паров на величину Dр соответствует повышение температуры кипения DТкип при р0 = 1,013×105 Па.
Повышение температуры кипения раствора по сравнению с чистым растворителем прямо пропорционально концентрации растворенного вещества:
DТкип= Kэб×См,
где DТкип – повышение температуры кипения раствора по сравнению с чистым растворителем; См – моляльная концентрация растворенного вещества (число молей растворенного вещества, содержащихся в 1 кг растворителя); Kэб – эбуллиоскопическая постоянная растворителя. Она характеризует растворитель и не зависит от природы растворенного вещества. Эбуллиоскопическую постоянную растворителя можно вычислить, зная его температуру кипения (Tкип,К) и энтальпию парообразования (DvH, Дж/кг):
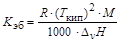 ,
,
R – универсальная газовая постоянная; М – молярная масса растворителя.
Кристаллизация раствора происходит при температуре более низкой, чем температура кристаллизации чистого растворителя. Это вызвано взаимодействием частиц растворенного вещества с молекулами растворителя, которое препятствует образованию кристаллической структуры. На диаграмме состояния (см. рис.3.4) понижение температуры кристаллизации DТкр соответствует расстоянию между кривыми 2¢ и 2, измеренному по изобаре р0 = 1,013×105 Па.
Понижение температуры кристаллизации раствора по сравнению с чистым растворителем прямо пропорционально концентрации растворенного вещества:
DТкр= Kкр×См,
где DТкр– понижение температуры кристаллизации раствора по сравнению с чистым растворителем; Kкр – криоскопическая постоянная растворителя. Она характеризует растворитель и не зависит от природы растворенного вещества.
Криоскопическую постоянную растворителя можно вычислить, зная температуру кристаллизации растворителя (Tкр,К) и энтальпию плавления(DmH, Дж/кг):
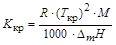 .
.
Эбуллиоскопические и криоскопические постоянные некоторых растворителей:
| Растворитель | Ткип °С | Kэб К×кг/моль | Ткр °С | Kкр К×кг/моль |
| Вода H2O | 0,51 | 1,86 | ||
| Ацетон (CH3)2CO | 56,3 | 1,71 | -95 | 2,40 |
| Бензол C6H6 | 80,1 | 2,53 | 5,53 | 5,12 |
| Четыреххлористый углерод CCl4 | 76,7 | 4,95 | -23 |
Свойства растворов, зависящие от числа частиц растворенного вещества, а не от их химической природы, в частности повышение температуры кипения и понижение температуры кристаллизации, получили название коллигативных свойств.
В растворе электролита за счет диссоциации увеличивается число частиц по сравнению с раствором неэлектролита той же концентрации. Это должно отразиться на коллигативных свойствах растворов электролитов. Следовательно, повышение температуры кипения и понижение температуры кристаллизации растворов будет зависеть не только от концентрации, но и от степени диссоциации растворенного вещества. Кроме того, при диссоциации молекулы в зависимости от ее химического состава образуется различное количество ионов. Увеличение числа частиц в растворе электролита характеризует изотонический коэффициент (i).
Если при растворении вещества KatxAny устанавливается динамическое равновесие: KatxAny Û x Kat+ + y An-, то изотонический коэффициент равен отношению суммарного числа частиц (ионов и недиссоциированных молекул) в растворе к числу растворенных молекул:
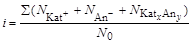 ,
,
где N0– число молекул растворенного вещества; S(Ni) – суммарное число катионов, анионов и недиссоциированных молекул растворенного вещества.
Если степень диссоциации вещества равна a, то с учетом уравнения диссоциации изотонический коэффициент
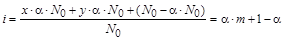 ,
,
i =a×(m –1)+1,
где x – число катионов, y – число анионов, m = x + y – суммарное число частиц, образующихся в результате единичного акта диссоциации.
В случае сильного электролита (a®1) все растворенные молекулы распадаются на ионы и изотонический коэффициент равен i = m.
Пример.
NaCl ® Na+ + Cl- i = m =1+1=2,
K2SO4 ® 2 K+ + SO4-2 i = m =2+1=3.
В соответствии с изотоническим коэффициентом в i раз возрастают эффекты повышения температуры кипения и понижения температуры кристаллизации, а также величины относительного понижения давления насыщенных паров растворителя:
DТкип= i×Kэб×См ,DТкр = i×Kкр×См , 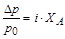 .
.
Библиографический список
1.М.Х. Карапетьянц Химическая термодинамика. М.: Химия, 1975. 584 с.
2. Пригожин И., Кондепуди Д. Современная термодинамика. М.: Мир, 2002. 461с.
3.Эмануэль Н.М., Кнорре Д.Г. Курс химической кинетики. М.: Высшая школа, 1984. 463 с.
4. Денисов Е.Т. Кинетика гомогенных химических реакций. М.: Высшая школа, 1988. 391 с.
5. Горбунов А.И., Гуров А.А., Филиппов Г.Г., Шаповал В.Н. Теоретические основы общей химии. М.: МГТУ им. Н.Э. Баумана, 2001. 720 с.
6.Хаускрофт К., Констебл Э. Современный курс общей химии. М.: Мир, 2002. Т.1,2.
7.Слесарев В.И. Химия – основы химии живого. СПб.: Химиздат, 2000. 767 с.
8.Физическая химия / Под ред. К.С. Краснова. М.: Высшая школа, 2001. Кн.1 – 512 с., Кн. 2 – 319 с.
9. Стремберг А.Г., Семченко Д.П. Физическая химия. М.: Высшая школа, 2001. 527 с.
10. Кнорре Д.Г., Крылова Л.Ф., Музыкантов В.С. Физическая химия. М.: Высшая школа, 1990. 416с.
11. Пикаев А.К. Современная радиационная химия: В 3 т. М.: Наука, 1985.
12. Франк–Каменецкий Д.А. Диффузия и теплопередача в химической кинетике. М.: Наука, 1987. 491 с.
13. Челышев В.П., Шехтер Б.И., Шушко Л.А. Теория горения и взрыва. М.: МО СССР, 1970. 521 с.
14. Краткий справочник физико-химических величин / Под ред. А.А. Равделя и А.М. Пономаревой. Л.: Химия, 1983. 232 с.
15. Общая химия / Под ред. Е.М. Соколовой, Г.Д. Вовченко, Л.С. Гузея. М.: Изд-во Моск. ун-та, 1980, 726 с.
Киселев Алексей Петрович, Крашенинников Александр Алексеевич
Основы общей химии
Часть 2
