Диффузия и осмос. Осмотическое давление
Если поверх концентрированного раствора какого-либо вещества, помещённого в цилиндрический сосуд, осторожно налить, избегая перемешивания, слой более разбавленного раствора или растворителя, то через некоторое время концентрации растворённого вещества в любой части раствора сравняются. Такое постепенное выравнивание концентрации объясняется стремлением частиц обоих компонентов раствора – растворителя и растворённого вещества – к равномерному распределению по всему объёму раствора. При этом частицы, проявляя общую тенденцию к увеличению неупорядоченности, движутся от места с большей концентрацией к месту с меньшей концентрацией. Частицы растворённого вещества проникают в среду частиц растворителя, а частицы растворителя – в среду растворённого вещества. Это явление, обусловленное тепловым движением молекул, называется диффузией.
Рассмотрим случай диффузии, когда раствор и растворитель разделены перегородкой, которая проницаема только для молекул растворителя и непроницаема для молекул растворённого вещества. Такая перегородка называется полупроницаемой.
Полупроницаемая перегородка нашла своё применение в приборе, который называется осмометром.
Представим себе два сосуда, расположенных один в другом. Пусть дно внутреннего сосуда сделано из материала, который проницаем только для молекул воды (растворителя) и не пропускает молекулы растворённого вещества, имеющие большие размеры. Во внутренний сосуд нальём раствор сахара, а во внешний – воду.
Хотя молекулы воды могут проникать через полупроницаемую перегородку в обе стороны, но скорость её прохождения из наружного раствора во внутренний будет больше, чем в обратном направлении. Молекулы растворителя из объёма с их большей концентрацией (из чистой воды) будут диффундировать через полупроницаемую перегородку в водный раствор сахара, где их концентрация меньше. Это явление – самопроизвольный переход растворителя в раствор, отделённый от него полупроницаемой перегородкой, - называется осмосом.
Сила (на единицу площади), заставляющая растворитель переходить через полупроницаемую перегородку в раствор (находящийся при том же внешним давлении, что и растворитель), называется осмотическим давлением.
Вследствие осмоса уровень раствора в сосуде 1 повышается, создавая дополнительное давление, которое препятствует осмосу. При некоторой высоте h столба жидкости в сосуде 1 дополнительное давление достигнет такой величины, при которой осмос прекращается, т.е. устанавливается равновесие между раствором данной концентрации и чистым растворителем, разделёнными полупроницаемой перегородкой. Если увеличивать давление в сосуде 1, то можно заставить воду переходить из сосуда 1 во внешний сосуд 2. При этом концентрация раствора в сосуде 1 будет возрастать до тех пор, пока не достигнет значения, соответствующего увеличенному давлению; установится новое равновесие между раствором и растворителем.
Таким образом,
равновесию между раствором заданной концентрации и чистым растворителем, разделёнными полупроницаемой перегородкой, соответствует определённое гидростатическое давление в сосуде с раствором.
Это давление равно осмотическому давлению и отличается от него только знаком.
Поскольку реально измеряемой величиной является именно гидростатическое давление, можно и само осмотическое давление определить, как дополнительное давление, которое необходимо приложить к раствору, чтобы предотвратить поступление (или удаление из него) растворителя через полупроницаемую перегородку.
В 1887 году Пфеффер экспериментально установил две закономерности, которым подчиняется осмотическое давление неэлектролита.
1) В разбавленных растворах неэлектролитов при данной температуре осмотическое давление прямо пропорционально концентрации
πосм = К1с.
2) При одной и той же концентрации С (моль/л) осмотическое давление разбавленного раствора прямо пропорционально абсолютной температуре
πосм = К2сТ
Оказалось, что в растворах, к которым применимо последнее уравнение, осмотическое давление совсем не зависит от вида растворённого вещества, ни от растворителя и коэффициент пропорциональности К в этом уравнении является универсальной постоянной, которая к тому же численно равна газовой постоянной R. Таким образом, зависимость осмотического давления от концентрации и температуры может быть представлена соотношениенм
πосм = сRT
Данное уравнение применимо к любым достаточно разбавленным раствором, за исключением растворов, в которых происходит электролитическая диссоциация. При диссоциации в растворе увеличивается число частиц растворённого вещества, что и вызывает увеличение осмотического давления. Уравнение по форме вполне совпадает с уравнением состояния идеальных газов (pv = nRT), так как связь между концентрацией и объёмом выражается соотношением с =n/V.
На основе этого в 1884 г. Вант-Гофф вывел уравнение πосм = cRT и пришел к заключению, что
осмотическое давление равно тому газовому давлению, которым обладало бы растворённое вещество, если бы, находясь в газообразном состоянии при той же температуре, оно занимало тот же объём, который занимает раствор.
Это положение известно в науке как закон Вант-Гоффа для осмотического давления. Закономерность, установленная Вант-Гоффом, так же как и законы Рауля, используются для определения молекулярных масс растворённых веществ. Осмотический метод оказался применимым также для определения молекулярной массы высокомолекулярных соединений. Соотношения Рауля для этой цели неприемлемы. Зависимость осмотического давления растворённого высокомолекулярного вещества от его концентрации описывается соотношением
πосм = 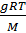 + A∙
+ A∙ 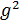
или
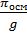 =
= 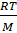 + A∙g
+ A∙g
где g – масса вещества в граммах.
Член ( A∙ 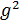 ) учитывает специфику полимерных молекул. Экспериментальным путём находят зависимость величины πосм/g от весовой концентрации соединения. Экстраполируя осмотическое давление πосм/g к нулевой концентрации, определяют длину отрезка на оси ординат, которая численно равна величине RT/M.
) учитывает специфику полимерных молекул. Экспериментальным путём находят зависимость величины πосм/g от весовой концентрации соединения. Экстраполируя осмотическое давление πосм/g к нулевой концентрации, определяют длину отрезка на оси ординат, которая численно равна величине RT/M.
Из этих данных рассчитывают молекулярную массу высокомолекулярного соединения.
Растворы, осмотические давления которых одинаковы, называются изотоническими (или изоосмотическими). Изотонические растворы содержат одинаковое количество осмотически активных частиц. Осмотическое давление крови равно 760-800 кПа при 370С. Изотоничными крови являются растворы хлорида натрия с массовой долей NaCl 0,85-0,90% (0,15 моль/л) или растворы глюкозы с массовой долей глюкозы 4,5-5% (0,30 моль/л). Эти растворы широко применяются в медицинской практике.
Если два раствора имеют различное осмотическое давление, то раствор с большим осмотическим давлением называется гипертоническим по отношению ко второму, а раствор с меньшим осмотическим давлением – гипотоническим по отношению к первому.
В клинической практике осмотическое давление биологических жидкостей (плазмы крови, мочи, слюны, молока) часто измеряют в единицах осмолярности или осмоляльности.
Под осмолярностью (и осмоляльностью)понимают суммарную концентрацию частиц (молекул, ионов, коллоидных частиц органических и неорганических веществ), не проникающих через полупроницаемую мембрану. Единицы измерения осмолярности совпадают с единицами измерения молярной концентрации (моль/л), а осмоляльности – с моляльностью (моль/кг). Для разбавленных растворов можно принять, что численные значения осмолярности и осмоляльности совпадают.
Осмос и клетки растений
Для иллюстрации роли осмоса в природе рассмотрим механизм поступления воды и минеральных солей в ствол дерева. Клетки корневой системы растений находятся в почве и соприкасаются с почвенной жидкостью. Содержание солей в ней обычно меньше, чем в соке клеток корневой системы (вернее, почвенная влага имеет меньшее осмотическое давление). Такие растворы называют гипотоническими. Из гипотонического раствора за счёт осмоса вода засасывается в первые клетки растений, разбавляя в них клеточный сок, который становится гипотоническим по отношению к соку в следующих клетках, расположенных выше, и поэтому вода переходит в эти клетки и т.д. Таким образом, от клетки к клетке вода подаётся по стволу дерева и может подниматься на многие десятки метров.
Осмосом легко объясняется плохое произрастание растений на засолённых почвах. На солончаках вблизи моря (или солёных озёр) почва имеет высокую влажность и содержит вполне достаточное количество необходимых для жизни растений минеральных солей. Однако, если осмотическое давление почвенной жидкости выше осмотического давления клеточного сока, эта жидкость становится недоступной для растений. Осмос в этом случае идёт в обратном направлении: вода переходит из клеточного сока в почвенную жидкость. Такой переход воды из клеточного сока в почвенную жидкость называется экзоосмосом. А переход воды из из почвенной жидкости в клетку называют эндоосмосом. Вследствие экзоосмоса на солончаках растения погибают, так как почва «высасывает» из них влагу.
Осмосом объясняется также упругость тканей живых растений и животных, или так называемый тургор.
