Для отчётов по лабораторным работам по химии
Министерства здравоохранения Российской Федерации
(ФГБОУ ВО Тюменский ГМУ Минздрава России)
ТЕТРАДЬ
Для отчётов по лабораторным работам по химии
студента_______________________________________
группы №_________
Тюмень, 2017
Тематический план лабораторных и практических занятий по дисциплине «Химия»
для студентов лечебного и педиатрического факультета
I семестр 2017-2018 уч. год
| № занятия | Тематика занятий | дата | |
| Модульная единица 1.1. Основы химической термодинамики и кинетики, свойства растворов, Редокс-процессы | |||
| 1.1.1. | Введение в курс химии. Окислительно-восстановительные реакции. Электродные процессы. | 04 - 09 сентября | |
| 1.1.2. | Основы химической термодинамики и биоэнергетики. Термодинамика химического равновесия. Лабораторная работа №1 «Качественные опыты по химическому равновесию» | 11-16 сентября | |
| 1.1.3. | Растворы. Коллигативные свойства растворов. Лабораторная работа №2 «Определение осмотической концентрации и изотонического коэффициента раствора электролита» | 18-23 сентября | |
| 1.1.4 | Протолитические реакции. Буферные растворы. Лабораторная работа №3 «Свойства буферных растворов». | 25-30 сентября | |
| 1.1.5. | Химическая кинетика и катализ. Лабораторная работа №4 «Изучение зависимости скорости реакции от концентрации и температуры». Контроль по модульной единице 1.1. | 02-07 октября | |
| Модульная единица 1.2. Биологически активные неорганические соединения (строение, свойства, участие в функционировании живых систем). Физико-химия поверхностных явлений и свойства дисперсных систем | |||
| 1.2.1. | Химия биогенных элементов s,р,d-блока. (внеаудиторная контактная работа) | ||
| 1.2.2. | Химия биогенных элементов s-и p-блока. Лабораторная работа №5 «Химические свойства s-и p-элементов, их применение в медицине». | 09-14 октября | |
| 1.2.3. | Химия биогенных элементов d-блока. Лигандообменные процессы. Строение металлоферментов, биокомплексных соединений. Лабораторная работа №6 «Химические свойства d-элементов». | 16-21 октября | |
| 1.2.4. | Физико-химия поверхностных явлений в функционировании живых систем. Лабораторная работа №7 «Адсорбционные процессы» | 23-28 октября | |
| 1.2.5. | Физико-химия дисперсных систем в функционировании живых систем. Лабораторная работа №8 «Свойства коллоидных растворов». Контроль по модульной единице 1.2. | 30 октяб.- 04 ноября | |
| Модульная единица 1.3. Низкомолекулярные биорегуляторы и биологически активные высокомолекулярные соединения (строение, свойства, участие в функционировании живых систем) | |||
| 1.3.1. | Полифункциональные соединения (многоатомные спирты и фенолы, полиамины, двухосновные карбоновые кислоты). Лабораторная работа №9 «Свойства одно-и-многоатомных спиртов и фенолов» | 06-11 ноября | |
| 1.3.2. | Гетерофункциональные соединения (аминоспирты, гидрокси- и аминокислоты, оксокислоты. | 13-18 ноября | |
| 1.3.3. | Биологически важные ароматические и гетероциклические соединения. | 20-25 ноября | |
| 1.3.4. | Важнейшие α-аминокислоты, пептиды. Лабораторная работа №10 «Химические методы обнаружения аминокислот и белков» | 27 ноября-02 декабря | |
| 1.3.5. | Углеводы. Лабораторная работа №11 «Качественные реакции на углеводы и их функциональные группы» | 04-09 декабря | |
| 1.3.6. | Нуклеиновые кислоты. Лабораторная работа №12 «Определение состава нуклеопротеидов». Зачёт: практические умения. | 11-16 декабря | |
| 1.3.7. | Высшие жирные кислоты. Липиды. Контроль по модульной единице 1.3. Зачёт: теоретическая подготовка (итоговое тестирование) | 18-23 декабря | |
ПРАВИЛА
Меры первой помощи
1. При химических ожогах нужно удалить вещество, вызвавшее ожог, а затем обработать кожу соответствующим образом:
- при ожогах кислотой или щелочью вытереть кожу тряпкой, затем промыть струей воды
и нейтрализовать остатки кислоты 1% раствором бикарбоната натрия, при ожогах
щелочью - 1% раствором уксусной кислоты;
- при ожогах бромом пораженное место обрабатывают 10% раствором гипосульфита
натрия, затем все смывают большим количеством воды
- при ожогах фенолом кожу растирают глицерином, обмывают водой с мылом
2. При загораниях выключают вытяжную систему, гасят пламя песком или накрывают негорючим одеялом.
3. При отравлениях газами пострадавшего выводят на свежий воздух и вызывают врача.
4.
С правилами техники безопасности ознакомлен ________________(подпись)
ФОРМА ОТЧЕТА
Занятие 1.1.2.
ТЕМА: Основы химической термодинамики и биоэнергетики. Термодинамика химического равновесия.
ЦЕЛЬ: Научиться формулировать и применять основные положения термодинамики к физическим и химическим процессам.
Лабораторная работа №1
Выполнение эксперимента
Опыт 1. Смещение химического равновесия при изменении концентрации реагентов
Для опыта воспользуемся реакцией образования железа (III) тиоцианата:
FeCl3+ 3KNCS « Fe(NCS)3 + ЗКС1
(точнее, в данной реакции получаются тиоцианатные комплексы железа (III) с числом тиоцианатных групп у атома железа от 1 до 6).
Железо (III) тиоцианат интенсивно окрашен в красный цвет, раствор FeCl3 - в желтоватый, а растворы KNCS и КС1 бесцветны. При изменении концентрации Fe(NCS)3 окраска раствора изменяется, что позволяет визуально установить направление смещения равновесия.
К 20 мл воды в небольшом стакане прибавьте по 1-2 капли насыщенных растворов FeСl3 и KNCS. Полученный раствор разлейте в четыре пробирки. Затем в 1-ю пробирку прибавьте несколько капель концентрированного раствора FeСl3. Что наблюдаете? Запишите в таблицу наблюдаемое изменение окраски и укажите направление смещения равновесия (стрелка вправо или влево).
Затем во 2-ю пробирку прибавьте несколько капель концентрированного раствора KNCS. Снова отметьте наблюдения и запишите в таблицу наблюдаемое изменение окраски и укажите направление смещения равновесия. Наконец, в З-ю пробирку прибавьте немного кристаллического КС1. Сравните окраску в З-й пробирке после прибавления КС1 с окраской раствора в пробирке сравнения, запишите изменение окраски в таблицу и укажите направление смещения равновесия. Запишите, соответствуют ли наблюдаемые смещения химического равновесия принципу Ле Шателье.
| Пробирка | Добавлено в пробирку | Наблюдение - изменение интенсивности окраски | Вывод - направление смещения равновесия |
| FeCl3 (р) | |||
| KNCS (р) | |||
| KCl (т) | |||
| контроль |
Опыт 2. Смещение химического равновесия при изменении температуры.
В стакане вместимостью 250 мл нагрейте воду (почти до кипения). В две пробирки внесите по 4-5 мл крахмала и прибавьте туда же по 3-4 мл раствора дииода. Запишите наблюдения (цвет образовавшегося раствора). Нагрейте одну из пробирок, опустив ее на несколько минут в стакан с горячей водой. Вторую пробирку оставьте для сравнения. Наблюдайте изменение окраски. Как изменяется окраска раствора в нагретой пробирке по сравнению с холодной? Запишите наблюдения. Охладите нагретую пробирку. Что происходит? Запишите уравнение изученного равновесия:
I2 + крахмал « [I2 ×Крахмал]
желтый бесцветный синий
Наблюдения:
______________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________
Основываясь на результатах наблюдений, сделайте вывод о направлении смещения равновесия в системе при ее нагревании и охлаждении. Исходя из принципа Ле Шателье, ответьте на вопрос: - экзо- или эндотермической является реакция образования иодокрахмала и реакция его диссоциации?
Выводы:
______________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________
Вопросы к защите работы
1. Запишите выражение констант равновесия работе (ЗДМ), изученных вами реакций.
______________________________________________________________________________________________________________________________________
_____________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________
2. Сформулируйте принцип Ле-Шателье.
______________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________
3. Влияет ли катализатор на положение равновесия? Зависит ли числовое значение константы равновесия от катализатора?
______________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________
4. При увеличении температуры увеличиваются скорости как прямой, так и обратной реакций. Почему же наблюдается смещение равновесия? Изменяется ли при этом константа химического равновесия?
______________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________
5.В какую сторону сместится равновесие СО(г) + Н2О(г)↔СО2(г) + Н2, ΔН0 =-43 кДж
а) при уменьшении концентрации воды______________
б) при увеличении температуры____________________
в) при уменьшении давления_______________________
6. Изменяется ли константа химического равновесия при смещении равновесия в результате изменения концентрации какого-либо компонента системы?
______________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________
Занятие 1.1.3.
ТЕМА: Растворы. Коллигативные свойства ратворов
ЦЕЛЬ: Изучить коллигативные свойства растворов и приобрести навыки криометрических измерений.
Лабораторная работа №2
Занятие 1.1.4.
ТЕМА: Протолитические реакции. Буферные растворы.
ЦЕЛЬ: На основе теории кислотно-основных равновесий уяснить сущность протолитических процессов, протекающих в организме, механизмов действия буферных систем организма, их взаимосвязь и роль в поддержании кислотно-основного гомеостаза.
Лабораторная работа №3
Свойства буферных растворов
ЦЕЛЬ: Приобрести навыки в приготовлении буферных смесей с определенным значением рН; изучить некоторые свойства буферных растворов.
Оборудование: Штатив с пробирками, бюретки-3 шт., пипетки вместимостью 2 и 10 мл, конические колбы вместимостью 50 мл.
Реактивы: Растворы уксусной кислоты (0,1 и 1 моль/л), натрия ацетата (0,1 и 0,01 моль/л), НС1 (0,1 и 0,01 моль/л), NaOH (0,1 моль/л), 0,9%-ный NaCI; раствор универсального индикатора или универсальная индикаторная бумага и цветные таблицы для определения рН по окраске универсального индикатора.
Выполнение эксперимента.
Опыт 1. Приготовление буферных смесей с различным значением рН
В три одинаковые пробирки налейте из бюретки растворы уксусной кислоты (С = 0,1 моль/л) и натрия ацетата той же концентрации в объемах, указанных в таблице 1.
Таблица 1
| ПРОБИРКА | |||
| № 1 | № 2 | № 3 | |
| Объем раствора кислоты, мл | |||
| Объем раствора соли, мл | |||
| Соотношение (кислота) /[соль] | 9:1 | 1:1 | 1:9 |
| Значение рН, найденное в опыте | |||
| Значение рН вычисленное |
Прибавьте к каждому раствору по 3 капли раствора универсального индикатора. Сравните окраску растворов с окраской в специальной цветной таблице, прилагаемой к универсальному индикатору, при различных значениях рН. Запишите в таблицу 1 значения рН для каждого из растворов. Рассчитайте рН и также запишите их в таблицу.
______________________________________________________________________________________________________________________________________
Сравните действительные значения рН растворов с расчетными, сделайте выводы. Растворы сохраните для проведения следующих опытов.
Выводы:
______________________________________________________________________________________________________________________________________
Опыт 2. Влияние разбавления на рН буферной смеси.
Возьмите две чистые пробирки и отберите в них из пробирки № 2 пипеткой 1,0 и 2,0 мл буферного раствора. Разбавьте отобранные растворы водой в 10 и 5 раз соответственно. Прибавьте в разбавленные растворы по 3 капли раствора универсального индикатора.
Сравните окраску в этих пробирках с окраской исходного раствора и с окраской в цветной таблице для универсального индикатора. Изменяется ли рН при разведении буферного раствора? Сделайте выводы.
Выводы:
______________________________________________________________________________________________________________________________________
Опыт 3. Действие на буферные растворы кислот и щелочей.
Возьмите 3 чистые пробирки. В одну из них отберите пипеткой 5,0 мл буфера, приготовленного в опыте 1 в пробирке № 3. В другую чистую пробирку налейте 5 мл дистиллированной воды, в 3-ю - 5 мл 0,9%-ного раствора NaCI. В пробирки с водой и NaCI прибавьте по 3 капли раствора универсального индикатора. Для записи результатов наблюдений составьте таблицу №2:
Запишите в таблицу исходные значения рН растворов, определенные по окраске универсального индикатора. Прибавьте в пробирки по 1,00 мл раствора НС1 (С=0,01 моль/л).
Как изменяется окраска растворов в пробирках? Запишите новые значения рН растворов.
Затем прибавьте в эти же пробирки по 1,0 мл 0,1 моль/л раствора НС1. Запишите также полученные значения рН растворов.
Таблица №2
| Пробирка | Содержимое | Значение рН | ||
| исходное | после прибавления НС1 | |||
| 0,01 моль/л | 0,1 моль/л | |||
| Ацетатный буфер | ||||
| Вода | ||||
| Раствор NaCI |
Проделайте опыт, аналогичный опыту 3 с той лишь разницей, что в качестве исследуемого ацетатного буфера используйте буферный раствор, приготовленный в опыте 1 в пробирке № 1. К 5 мл буфера, воды и раствора NaCI прибавьте по 1,0 мл раствора NaOH вначале с концентрацией 0,01 моль/л, а затем с концентрацией 0,1 моль/л. Запишите также полученные значения рН растворов в таблицу №3
Таблица №3
| Пробирка | Содержимое | Значение рН | ||
| исходное | после прибавления NaOH | |||
| 0,01 моль/л | 0,1 моль/л | |||
| Ацетатный буфер | ||||
| Вода | ||||
| Раствор NaCI |
Сформулируйте выводы из опыта, основанные на наблюдениях.
Выводы:
______________________________________________________________________________________________________________________________________
__________________________________________________________________
Вопросы к защите работы
Занятие 1.1.5.
ТЕМА: Химическая кинетика и катализ.
ЦЕЛЬ: На основе законов кинетики химических реакций научится рассчитывать основные кинетические параметры и экспериментально изучит влияние различных факторов на скорость реакции.
Лабораторная работа №4
Занятие 1.2.2.
Лабораторная работа № 6
Наблюдения
_________________________________________________________________________________________________________________________________________________________________________________________________________
Сделайте вывод. Какие соединения алюминия используются в качестве антацидных средств? В каком виде соединения алюминия выводятся из организма?
______________________________________________________________________________________________________________________________________
Вопросы к защите темы.
1.На чём основано применение в медицине гипертонических растворов NaCl?
______________________________________________________________________________________________________________________________________
2.Объясните, почему ион Ba2+ токсичен для организма?
________________________________________________________________________________________________________________________________________________________________________________________________________
3.Напишите химическое уравнение, выражающее механизм выделения соляной кислоты из клеток слизистой оболочки желудка.
______________________________________________________________________________________________________________________________________
4.Какая химическая реакция лежит в основе токсического действия ионов Pb2+?
_________________________________________________________________________________________________________________________________________________________________________________________________________
5.С какой целью применяют NH4C1 в медицине? Укажите реакцию среды при гидролизе этой соли.
_________________________________________________________________________________________________________________________________________________________________________________________________________
6.Какая химическая реакция лежит в основе токсического действия нитритов?
_________________________________________________________________________________________________________________________________________________________________________________________________________
Занятие 1.2.3.
Лабораторная работа №6
Методика эксперимента.
а) в пробирку поместите 2-3 капли раствора FeSO4, добавьте каплю раствора гексацианоферата (III) калия - K3[Fe(CN)6]. Напишите уравнение реакции, дайте химическое название полученному веществу известному как турнбулева синь.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________________________________________________________________________________
Наблюдение: (Отметьте цвет осадка)
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
б) в пробирку поместите 2-3 капли раствора FeС13, добавьте каплю раствора гексацианоферрата (II) калия – K4[Fe(CN)6]. Напишите уравнение реакции, дайте химическое название полученному веществу известному как берлинская лазурь.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Наблюдение: (Отметьте цвет осадка)
_________________________________________________________________________________________________________________________________________________________________________________________________________
в) в пробирку поместите 1-2 мл раствора FeС13, добавьте несколько капель KCNS? Напишите уравнение реакции.
_________________________________________________________________________________________________________________________________________________________________________________________________________
Опишите наблюдения: (Какую окраску имеет полученное комплексное соединение K3[Fe(SCN)6)]?)
Выводы: (Сделайте вывод о возможности использования данных реакций для качественного обнаружения ионов Fe+2 и Fe+3 в растворах и биологических жидкостях)
_________________________________________________________________________________________________________________________________________________________________________________________________________
Вопросы к защите работы
1. В каких степенях окисления встречаются d-элементы в организме? Приведите примеры.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Как называются комплексные соединения d-элементов с органическими лигандами? Приведите примеры и назовите их.
_________________________________________________________________________________________________________________________________________________________________________________________________________
___________________________________________________________________
3. С какими веществами реагирует KMnO4, учитывая, что реакция используется как качественная?
_________________________________________________________________________________________________________________________________________________________________________________________________________
4. Какие ионы образуют окрашенные комплексные соединения: Cu+, Cu2+, Fe2+, Fe3+, Ag+, Zn2+, Co3+ ?
______________________________________________________________________________________________________________________________________
5. С помощью химических реакций докажите наличие ионов Cu2+ и Ag+ в водном растворе?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Занятие 1.2.4.
Классы красителей
Метиленовый синий __________________________
Эозин__________________________
______________________________________________________________________________________________________________________________________
Опыт №3. Качественный анализ смеси катионов Со2+, Сu2+, Fе3+ методом колоночной хроматографии. (демонстрационный)
Заполнение колонки адсорбентом производят следующим образом: нижний конец колонки закрывают комочком ваты, закрепляют колонку вертикально и заполняют её суспензией оксида алюминия в воде.
После вытекания воды добавление суспензии повторяют, пока слой адсорбента не составит 3-4см. Когда высота слоя воды над адсорбентом достигнет 3см, в колонку добавляют 1мл смеси катионов.
Наблюдения: (запишите или зарисуйте последовательность зон ионов)
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Вывод: Объясните последовательность расположения зон ионов.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Контрольные вопросы
1. Приведите примеры полярных и неполярных адсорбентов.
_________________________________________________________________________________________________________________________________________________________________________________________________________
2. В каких единицах выражается величина адсорбции на неподвижных границах раздела?
___________________________________________________________________
3. В чём заключаются особенности адсорбции твёрдыми адсорбентами различных веществ из растворов?
______________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________
4. Приведите примеры использования хроматографических методов в медицине и биологии.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Занятие 1.2.5.
Лабораторная работа №8
Занятие 1.3.1.
Лабораторная работа № 9
Опыт №2Образование иодоформа из спирта
Методика эксперимента Смешивают в пробирке 3-4 капли исследуемого спирта и 2-3 мл воды. Полученный раствор слегка нагревают (лучше всего на водяной бане при 60°С), добавляют к нему 0,5 -1,0 мл растворя йода и затем приливают разбавленный раствор щелочи по каплям до исчезновения окраски. В случае образования иодоформа выделяется светло-желтая муть или осадок и появляется характерный запах.
Химизм процесса: В условиях опыта йод и щелочь вступают в обратимую реакцию:

Образующаяся соль иодноватистой кислоты является сильным окислителем и переводит первичные спирты в альдегиды:
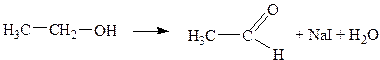
Вторичные спирты окисляются до кетонов. Атомы водорода в группах -СО-СН3, -СО-СН2-, -СО-СН- легко замещаются галогенами, в частности йодом.
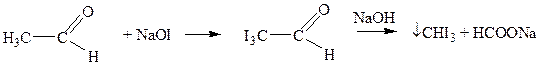
Ничтожно малая растворимость иодоформа в воде позволяет обнаружить по реакции его образования даже следы этилового спирта в водном растворе. Реакция широко используется в химико - токсикологическом анализе для установления алкоголя в желудке умерших людей.
Наблюдения:
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Выводы:___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт № 3 Комплексообразование многоатомных спиртов
Методика эксперимента. В пробирке получают гидроксид меди, для чего в разбавленный раствор сульфата меди вводят в небольшом избытке раствор едкой щелочи. Затем в пробирку добавляют 3-5 капель жидкого спирта (глицерина, этиленгликоля). Встряхнув пробирки, дают их содержимому отстояться и отмечают появление характерной окраски жидкости.
Химизм процесса: С увеличением числа гидроксильных групп в молекуле спирта кислотность спиртов возрастает, что определяет легкость образования с гидроксидом меди комплексных алкоголятов меди
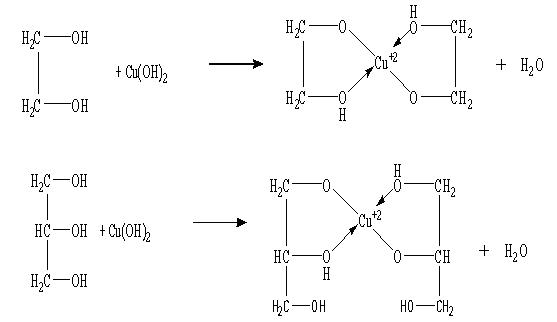
Наблюдения:
_________________________________________________________________________________________________________________________________________________________________________________________________________
Выводы:
______________________________________________________________________________________________________________________________________
Вопросы к защите работы.
1. Напишите уравнение реакции катехина (1,2-дигидроксибензола) с ацетатом свинца.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Напишите уравнение реакции окисления этанола бихроматом калия в кислой среде до уксусного альдегида. Расставьте соответствующие коэффициенты.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Какое значение имеет реакция образования иодоформа?
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Занятие 1.3.4.
Лабораторная работа № 10
Химизм процесса
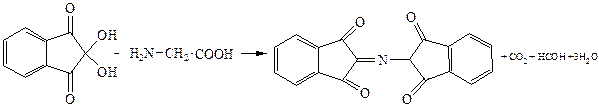
Наблюдения,отметьте цвет продукта:__________________________________
___________________________________________________________________
Выводы:_________________________________________________________________________________________________________________________________________________________________________________________________
Химизм процесса
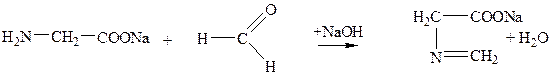
внутренняя соль метиленимин глицина
(нейтральная среда)
Наблюдения:
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Выводы:___________________________________________________________
______________________________________________________________________________________________________________________________________
Химизм процесса
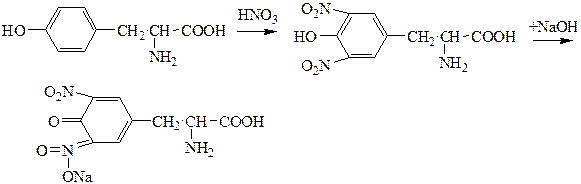
хиноидная структура
Наблюдения:
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Выводы:
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Химизм процесса
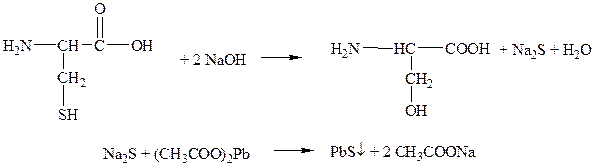
Наблюдения:
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Выводы:_________________________________________________________________________________________________________________________________________________________________________________________________
Вопросы к защите работы.
1. Какое практическое значение имеет реакция a-аминокислот с нингидрином?
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Напишите уравнение реакции метионина с формальдегидом.
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Напишите уравнение реакции метионина со щелочью с последующим добавлением ацетата свинца.
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Напишите уравнение реакции взаимодействия фенилаланина с азотной кислотой.
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. Приведите химизм взаимодействия a-аланина с хлороводородной кислотой и гидроксидом натрия.
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
6. Каковы внешние признаки биуретовой реакции?
_________________________________________________________________________________________________________________________________________________________________________________________________________
7. Какие a-аминокислоты в составе белка могут быть обнаружены с помощью ксантопротеиновой реакции?
______________________________________________________________________________________________________________________________________
Занятие 1.3.5.
Углеводы
Лабораторная работа № 11
Химизм процесса
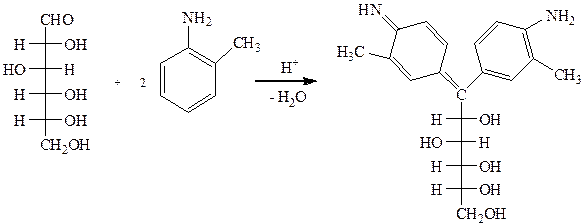
D-глюкоза о-толуидин
Наблюдения:
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Выводы:
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Химизм реакции.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Наблюдения: ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Вывод:
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт № 5(а) Реакция Толленса (реакция «серебрянного зеркала»).
Методика эксперимента. В тщательно вымытую пробирку прилить 0,5 мл 1 % раствора нитрата серебра, добавить по каплям 10% раствор аммиака до полного растворения образующегося вначале осадка. К полученному раствору добавить1% раствора гидроксида натрия и мл 1% раствора глюкозы. Пробирку осторожно нагреть в пламени спиртовки, перемешивая содержимое. Если пробирка была обезжирена (обработана раствором спирто-эфирной смеси), то на ее стенках выделяется слой серебра (зеркало), в противном случае выпадает черный осадок. Ранее реакцию широко использовали для изготовления елочных украшений.
Химизм процесса: 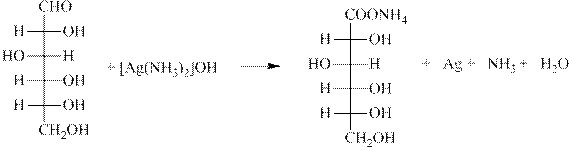
D-глюкоза
Наблюдения:___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Выводы:_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Лабораторная работа № 12
Опыт №2. Образование серебряной соли пуринов (серебряная проба на пуриновые основания).
Методика эксперимента:К 10 каплям гидролизата добавляют 10 капель раствора аммиака, затем добавляют 10 капель 2% раствора нитрата серебра. Содержимое пробирки перемешивать при стоянии не надо.
Химизм процесса:

Наблюдения отметьте в таблице.
Химизм реакции
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
В таблице отметьте аналитический эффект реакции Молиша.
Министерства здравоохранения Российской Федерации
(ФГБОУ ВО Тюменский ГМУ Минздрава России)
ТЕТРАДЬ
для отчётов по лабораторным работам по химии
студента_______________________________________
группы №_________
Тюмень, 2017
Тематический план лабораторных и практических занятий по дисциплине «Химия»
для студентов лечебного и педиатрического факультета
I семестр 2017-2018 уч. год
| № занятия | Тематика занятий | дата |
| Модульная единица 1.1. Основы химической термодинамики и кинетики, свойства растворов, Редокс-процессы | ||
| 1.1.1. | Введение в курс химии. Окислительно-восстановительные реакции. Электродные процессы. | 04 - 09 сентября |
| 1.1.2. | Основы химической термодинамики и биоэнергетики. Термодинамика химического равновесия. Лабораторная работа №1 «Качественные |
