Определение величины рн и свойства буферных систем
Многие химические реакции протекают при определенном значении рН раствора. Это касается, в первую очередь, живых систем, в которых процессы протекают в достаточно узких диапазонах рН. Кроме того, для ряда технологических процессов также требуется поддержание постоянного рН.
В химической практике используют буферные растворы − растворы, способные сохранять определенное значение рН при разбавлении или добавлении небольших количеств кислот или оснований.
Буферные растворы состоят из слабой кислоты и соли этой кислоты или слабого основания и соли этого основания. Например, ацетатный буфер состоит из уксусной кислоты и ацетата натрия СН3СООН/СН3СООNa. Он содержит кислоту, поэтому имеет кислотный рН. Аммонийный буфер состоит из аммиака и соли аммония NH4OH/NH4Cl и является основным буферным раствором. Используя различные пары кислот и оснований, можно приготовить буферные растворы с почти любым значением рН.
Рассмотрим равновесия в ацетатном буферном растворе.
Уксусная кислота – слабый электролит, диссоциирует в водном растворе по схеме:
СН3СООН ↔ СН3СОО- + Н+
Ацетат натрия – сильный электролит, полностью распадается на ионы:
СН3СООNa → CH3COO- + Na+
Наличие в растворе ацетат-ионов из ацетата натрия сдвигает равновесие диссоциации уксусной кислоты влево, т.е. подавляет ее диссоциацию. В результате количество ацетат-ионов в растворе соответствует концентрации ацетата натрия. А вся кислота находится в недиссоциированном виде.
Запишем выражение для константы диссоциации уксусной кислоты:
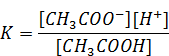
В этом выражении концентрация ацетат иона [CH3COO-] равна концентрации соли − ацетата натрия. Концентрация кислоты [CH3COOН] равна исходной концентрации кислоты. Таким образом можем записать:
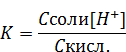
Откуда выразим концентрацию ионов водорода в буферном растворе:
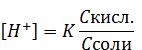
Формулу для расчета рН кислотного буферного раствора получим, прологарифмировав выражение:
рН = pKкисл + lgCсоли – lgCкисл.
Расчет рН основного буферного раствора осуществляется по формуле:
рН = 14 – рКосн + lgCосн – lgCсоли
Механизм буферного действия
Рассмотрим, какие процессы будут происходит ь в ацетатном буферном растворе (СН3СООН/СН3СООNa) при добавлении сильных кислот и оснований.
При добавлении к такому буферу сильной кислоты, например, HCl, произойдет взаимодействие ее с ацетатом натрия:
СН3СООNa + HCl = CH3COOH + NaCl
В итоге образуется слабая уксусная кислота и предотвращается понижение рН.
При добавлении щелочи, например, NaOH, произойдет реакция нейтрализации с уксусной кислотой:
CH3COOH + NaOH = CH3COONa + H2O
В результате заметного повышения рН не произойдет.
Безусловно, способность «сопротивляться» изменению рН при добавлении кислот и щелочей не безгранична и зависит от концентрации компонентов буферного раствора. Характеристикой этой способности является величина буферной емкости.
Буферная емкость – количество кислоты или щелочи, которое нужно добавить к 1 л буферного раствора для изменения значения рН на 1.
Работа № 9
ГИДРОЛИЗ СОЛЕЙ
Гидролиз – это взаимодействие веществ с водой, в результате которого происходит изменение рН среды.
Рассмотрим гидролиз солей. Соли – вещества, состоящие из катиона металла и аниона кислотного остатка. По тому, какой металл и анион какой кислоты входят в состав соли, все соли можно разделить на 4 типа:
1 тип. Соли сильного основания и сильной кислоты. Сильные основания – основания щелочных и щелочно-земельных металлов. Сильные кислоты – HCl, HBr, HI, HNO3, H2SO4, HClO4. Примеры солей 1 типа: NaCl, K2SO4, CaCl2.
2 тип. Соли сильного основания и слабой кислоты. Слабыми кислотами являются HF, H2SO3, H2CO3, H3PO4, H2SiO3, H2S, CH3COOH, HNO2, HCN. Примеры солей 2 типа: Na2CO3, K2S, CH3COONa.
3 тип. Соли слабого основания и сильной кислоты. Слабые основания образует большинство металлов (за исключением металлов I и II групп Периодической системы), например Al, Zn, Fe, Cu и т.д., а также ион аммония NH4+. Примеры солей 3 типа: FeCl2, Al2(SO4)3, Cu(NO3)2, NH4Cl.
4 тип. Соли слабого основания и слабой кислоты. Например, Al2S3, CH3COONH4, CuCO3.
Рассмотрим взаимодействие с водой солей всех четырех типов.
1) Соли 1 типа гидролизу не подвергаются! Среда растворов таких солей нейтральная (рН=7). Для них можно написать только уравнение диссоциации:
NaCl → Na+ + Cl-
2) Соли 2 типа гидролизуются по аниону. Сначала запишем уравнение диссоциации:
Na2CO3 → 2Na+ + CO32- (1)
Слабой частью является анион CO32-, который взаимодействует с водой, присоединяя протон H+:
CO32- + Н+ОН- → HCO3- + OH- (2)
При этом образовался гидрокабонат-ион HCO3- и гидроксид-анион OH-. Значит, среда в растворе будет щелочная (рН >7). Гидролиз идет только по первой ступени, т.е. реакция полученного аниона HCO3- с еще одной молекулой воды с образованием H2CO3 практически не идет. Гидролиз останавливается на этой стадии.
Уравнение (2) – ионная запись уравнения гидролиза. Для получения уравнения гидролиза в молекулярном виде, складываем уравнения (1) и (2), соединяя в правой части катионы с анионами. Получится:
Na2CO3 + CO32- + Н+ОН- → NaHCO3 + NaOH + CO32-
И после сокращения одинаковых ионов получим уравнение гидролиза:
Na2CO3 + Н2О « NaHCO3 + NaOH
В результате данной реакции гидролиза не выпадает осадков, не выделяется газов, т.е. реакция не идет до конца, является обратимой.
Итак, при гидролизе соли сильного основания и слабой кислоты, получается кислая соль, и раствор становится щелочным.
3) Соли 3 типа гидролизуются по катиону. Так же, как и в предыдущем примере, запишем уравнение диссоциации:
CuCl2 → Cu2+ + 2Cl- (3)
Выберем слабую часть и запишем ее взаимодействие с водой. Положительно заряженный ион меди Cu2+ присоединяет отрицательный гидроксид-ион:
Cu2+ + Н+ОН- → СuOH+ + H+ (4)
При этом образуется ион СuOH+ и протон H+. Это значит, что среда раствора – кислая (рН<0). Гидролиз останавливается на первой стадии, т.е. ион СuOH+ не будет принимать второй гидроксид-ион с образованием Сu(OH)2.
Уравнение (4) – запись гидролиза в ионном виде. Чтобы получить молекулярное уравнение, сложим уравнения (3) и (4) и получим:
CuCl2+ Н2О « СuOHCl + HСl
Так же, как для солей 2-го типа, гидролиз обратим.
Т.о., при гидролизе соли слабого основания и сильной кислоты образуется основная соль, и раствор становится кислым.
4) Соли 4 типа гидролизуются и по катиону, и по аниону. Чтобы записать уравнение гидролиза, надо провести реакцию обмена ионов между солью и водой. Катион будет взаимодействовать с гидроксид-ионами с образованием соответствующего гидроксида металла, а анион соединится с ионами водорода с образованием слабой кислоты. В этом случае гидролиз протекает до конца.
Al2S3 + HOH → Al(OH)3¯ + H2S
Ион алюминия гидролизуется по трем ступеням, т.е. присоединяет 3 гидроксид-иона, ион серы также гидролизуется до конца (по двум ступеням) с образованием сероводорода. Гидролиз в этом случае необратим, протекает до конца.
Работа № 12
