Получение продуктов на катоде и аноде
Цель работы: ознакомиться с процессом электролиза, с катодными и анодными реакциями
Задание: провести электролиз водного 1М раствора KI на графитовых электродах. Схема установки представлена на рисунке 8.2.
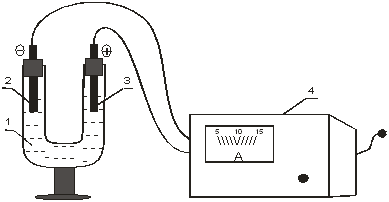
Рисунок 8.2 Установка для электролиза водного раствора KI:
1 – U-образная трубка с раствором KI; 2 – катод; 3 - анод;
4 – зарядное устройство.
Соберите установку в соответствии с рисунком 2. Графитовые стержни должны быть погружены в раствор электролита, но между поверхностью жидкости и резиновой пробкой должно быть свободное пространство. В прикатодное пространство капнуть 1-2 капли фенолфталеина.
Внимание! Включать установку в сеть только в присутствии преподавателя или лаборанта.
Перечислите письменно, какие процессы в принципе могут протекать на катоде и аноде в данной системе. Опишите свои наблюдения: какие цветовые изменения происходят в прикатодном и прианодном пространствах и почему? Какие вещества образуются при электролизе и дают такую окраску? Сделайте вывод, какой процесс идет на катоде и какой процесс идет на аноде.
Гальванотехника
Цель работы: получение электролитического медного или цинкового покрытия в заданных условиях, определение выхода металла по току и толщины полученного покрытия
Электролизер для получения гальванических покрытий представляет собой фарфоровый стакан ёмкостью 400 мл (рис. 8.3).
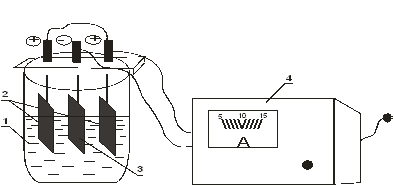
Рисунок 8.3. Установка для получения металлических покрытий:
1 – электролизер с электролитом; 2 – аноды; 3 - катод;
4 – зарядное устройство.
В процессе цинкования используются катоды из оцинкованного железа, в процессе меднения используются катоды из меди или латуни. В зависимости от вида наносимого покрытия применяют аноды из чистого цинка или меди. Центральный электрод – катод, подключается к « - » источника тока. По краям – два анода, подключаются к «+» источника тока. Крышка с закреплёнными электродами одевается на электролизёр.
Составы используемых электролитов:
цинкование – 430 г/л ZnSO4∙7H2O + 30 г/л Al2(SO4)3∙18 H2O + 50 г/л Na2SO4∙10∙H2O, рН = 3,5 ÷ 4,5.
Рабочая плотность тока 3 ÷ 7 А/дм2.
меднение – 250 г/л Cu SO4 ∙5H2O + 50 г/л H2SO4 + 50 г/л C2H5OH.
Рабочая плотность тока 0,5 ÷ 1,5 А/дм2.
Для выполнения задания необходимо:
1. Отберите нужные в соответствии с заданным видом покрытия электроды. Определите размеры катода и рассчитать его площадь, рабочими считаются обе стороны катода.
2. Зачистите электроды наждачной бумагой, обезжирьте катод с помощью кисточки, смоченной спиртоэфирной смесью (1:1). После обезжиривания электрод необходимо держать за токоподвод, не касаясь пальцами его поверхности.
3. Просушите катод на воздухе в течение 2-3 минут и взвесьте с точностью ±0,01 г.
4. Рассчитайте силу тока I, необходимую для проведения процесса при заданной преподавателем плотности тока.
5. Соберте электрическую схему установки для электролиза. Покажите её для проверки преподавателю.
6. Введите реостат в положение максимального сопротивления. Заполните электролизёр электролитом, соответствующим виду наносимого покрытия. Катод должен быть полностью погружён в электролит. Включите установку и секундомер, отрегулируйте силу тока до рассчитанного значения. Электролиз ведите в течение времени, указанного преподавателем.
7. После выключения тока катод промойте, высушите и взвесите. Аноды промойте, просушите и зачистите.
8. По результатам взвешиваний катода определите массу выделившегося металла: mпр. = m2 – m1. По объединённому уравнению законов Фарадея определите расчетную массу металла.
9. Рассчитайте выход металла по току.
10. Определите толщину покрытия:
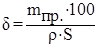 ,
,
где δ – толщина покрытия, мкм;
mпр. – масса выделившегося металла, г;
ρ – плотность металла, г/см3;
S – площадь катода, дм2.
Результаты измерений и расчётов занесите в таблицу 8.1.
Таблица 8.1
Результаты работы по получению покрытия
| 1. Заданная плотность тока i , А/дм2 | |
| 2. Площадь катода S, дм2 | |
| 3. Сила тока I, А | |
| 4. Время электролиза τ, с | |
| 5. Масса катода до электролиза m1, г | |
| 6. Масса катода после электролиза m2, г | |
| 7. Масса выделившегося металла mпр., г | |
| 8. Теоретическая масса покрытия mтеор., г | |
| 9. Выход металла по току ВТ, % | |
| 10.Толщина покрытия δ, мкм |
Плотность меди ρCu = 8,93 г/см3, ρZn = 7,13 г/см3.
Электрополирование
Цель работы : проведение электрохимического полирования поверхности металла, определение выхода металла по току и толщины съёма металла.
Электролизёр для полирования представляет собой фарфоровый стакан ёмкостью 400 мл (рис. 8.4).
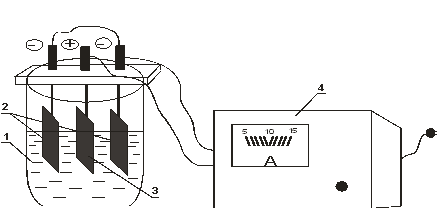
Рисунок 8.4 Установка для электрополирования меди:
1 – электролизер с электролитом; 2 – катоды; 3 - анод;
4 – зарядное устройство.
Центральный электрод – анод, подключается к «+» источника тока. По краям – катоды, подключаются к « - » источника тока. Все три электрода медные. Состав электролита: 1000 г/л H3PO4 + 40 мл/л бутилового спирта. Рабочая плотность тока ÷ 50 А/дм2.
Для выполнения задания необходимо:
1. Определите размеры анода и рассчитать его рабочую площадь (анод погружать в электролит наполовину, рабочими являются обе стороны).
2. Взвесите анод с точностью ±0,01 г.
3. Рассчитайте силу тока I, необходимую для проведения процесса при заданной плотности тока.
4. Соберите электрическую схему установки для электролиза. Покажите её для проверки преподавателю.
5. Введите реостат в положение максимального сопротивления. Заполните электролизёр электролитом. Включите установку и секундомер, отрегулируйте силу тока до рассчитанного значения. Электролиз ведите в течение 3 минут.
6. После выключения тока анод промойте дистиллированной водой, высушите и взвесьте. Катоды промойте водой, просушите и зачистите.
7. По результатам взвешиваний анода определите массу растворившегося при электрополировании металла: mпр. = m2 – m1. По объединённому уравнению законов Фарадея определите расчетную массу металла.
8. Рассчитайте выход металла по току.
9. Определите толщину съёма металла:
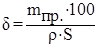 ,
,
где δ – толщина съёма, мкм;
mпр. – масса растворившегося металла, г;
ρ – плотность металла, г/см3 (плотность меди ρCu = 8,93 г/см3 );
S – площадь анода, дм2.
Результаты измерений и расчётов занесите в таблицу 8.2.
Таблица 8.2
Результаты работы по электрополированию меди
| 1. Заданная плотность тока i , А/дм2 | |
| 2. Площадь анода S, дм2 | |
| 3. Сила тока I, А | |
| 4. Время электролиза τ, с | |
| 5. Масса анода до электролиза m1, г | |
| 6. Масса анода после электролиза m2, г | |
| 7. Масса растворившегося металла mпр., г | |
| 8. Теоретическая масса покрытия mтеор., г | |
| 9. Выход металла по току ВТ, % | |
| 10.Толщина съёма δ, мкм |
СПИСОК ЛИТЕРАТУРЫ
1. Коровин Н.В. Общая химия. – М.: Высшая школа, 2004. – 557 с.
2. Глинка Н.Л. Общая химия. – М.: Интеграл-Пресс, 2007. – 728 с.
3. Ахметов Н.С. Общая и неорганическая химия. – М.: Высшая школа, 2006. – 743 с.
4. Глинка Н.Л. Задачи и упражнения по общей химии. – М.: Интеграл-Пресс, 2004. – 240 с.
5. Лидин Р.А. Задачи по общей и неорганической химии. – М.: Владос, 2004. –383 с.
6. Иванова Т.А., Прохорова В.И. Справочные таблицы к лабораторным, практическим работам по курсу «Химия». – Курган: изд-во КГУ, 1999. – 36 с.
ПРИЛОЖЕНИЕ 1
