Общие сведения об электролизе
Электролиз – окислительно-восстановительные реакции, протекающие на электродах под действием электрического тока, подаваемого от внешнего источника.
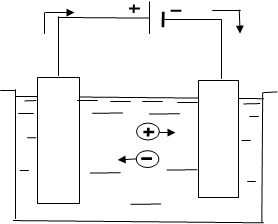
Для проведения электролиза в простейшем случае к полюсам внешнего источника постоянного тока подсоединяют два электрода, которые затем погружают в раствор или расплав электролита, находящийся в какой-либо емкости – электролизере или, иначе, электролитической ванне (рис. 8.1).
   |
ēē
Рис. 8.1 – Схема движения электронов и ионов при электролизе
Анод – электрод, на котором идет реакция окисления. При электролизе анод подключают к положительному полюсу источника тока.
Катод – электрод, на который идет реакция восстановления. При электролизе катод подключают к отрицательному полюсу источника тока.
Источник тока, подобно насосу, начинает перекачивать электроны от электрода, подсоединенного к положительному полюсу (аноду) к электроду, подсоединенному к отрицательному полюсу (катоду). Появление избытка электронов на катоде и их недостаток на аноде вызывает упорядоченное движение ионов в электролите: положительно заряженные ионы (катионы) перемещаются к катоду, отрицательно заряженные (анионы) – к аноду.
При контакте с катодом катионы приобретают электроны – восстанавливаются, анионы при контакте с анодом теряют электроны – окисляются. Таким образом, обеспечивается непрерывный направленный перенос зарядов по замкнутой цепи - электрический ток.
Электроды для проведения электролиза изготавливают из различных электронно-проводящих материалов – металлов или полупроводников. Аноды бывают растворимые и нерастворимые (инертные). Для изготовления нерастворимых анодов используют платину, золото, иридий, графит и ряд других веществ. В случае растворимых анодов основным источником электронов является не разряд ионов электролита или молекул растворителя, как при использовании нерастворимых анодов, а окисление и растворение самого материала анода, например:
Zn – 2ē→ Zn2+, Cu - 2 ē → Cu2+и т.п.
Количественно катодные и анодные реакции подчиняются законам Фарадея, которые можно выразить общей формулой:
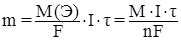
где m – масса вещества, выделившего на электроде;
k – электрохимический эквивалент этого вещества, т.е. масса вещества, которая выделяется на электроде при прохождении единицы количества электричества, г/Кл;
Q – количество электричества, прошедшее через электролит, Кл;
М(Э) – молярная масса эквивалента вещества, г/моль;
М – молярная масса вещества, г/моль;
F – число Фарадея, Кл/моль;
I– сила тока, А;
τ- время электролиза, с;
n– число электронов, участвующих в реакции.
Силу тока часто выражают через плотность тока:
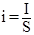
где i - плотность тока, т.е. сила тока, приходящаяся на единицу поверхности электрода, А/дм2;
I – сила тока, А;
S – площадь поверхности электрода, дм2 .
В случае выделения газообразных веществ удобнее массу mзаменить объемом V и, соответственно, молярную массу эквивалента выделяемого вещества М(Э) – объёмом, который она занимает V (Э).При нормальных условиях V0Э(О2) = 5,6л/моль, V0Э(Н2)=11,2 л/моль, V0Э( Cl2) = 11,2 л/моль.
Законы Фарадея являются общими и точными количественными законами электрохимии. Однако в большинстве случаев количество выделившегося вещества оказывается меньше, чем следовало ожидать по расчёту. Это связано с протеканием на электроде не одной главной реакции, но и побочных и вторичных реакций, на которые расходуется часть прошедшего электричества. Например, при гальваническом цинковании наряду с целевой реакцией осаждения цинка:
Zn2+ + 2ē →Zn
протекает побочная реакция выделения газообразного водорода:
2Н+ + 2ē →Н2
на которую также расходуется определённое количество электричества. Для учета потерь электричества используют понятие выхода по тока:
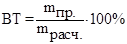
где  ВТ – выход вещества по току, %;
ВТ – выход вещества по току, %;
mпр. – масса вещества, практически получаемая при электролизе, г;
mрасч. – расчетная (ожидаемая) в соответствии с законами Фарадея масса вещества, г.
Законы Фарадея используются при проведении различных расчетов, связанных с практическим применением электролиза.
Чаще всего ВТ < 100%.
Пример 1.Электролитическое цинкование детали с поверхностью 2,5 дм2 проводили в течении 30 мин. при плотности тока 7 А/дм2. Выход по току цинка в условиях электролиза составлял 85%. Сколько цинка выделилось на поверхности детали?
Решение: Согласно объединённому уравнению законов Фарадея
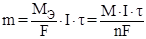 .
.
В нашем случае: М(Zn) = 65,38 г/моль; F = 96500 Кл/моль;
τ = 30∙60 = 1800 с; n = 2 (для электронной реакции Zn2+ + 2ē → Zn).
По определению i = I/S , где i – плотность тока, А/дм2; I– сила тока, А;
S – площадь поверхности покрываемой детали, дм2, I = 7∙2,5 = 17,5 А.
Тогда расчетная масса цинка
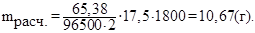
Практически на детали выделится
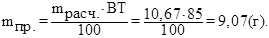
Пример 2. Сколько времени потребуется для электролиза водного раствора КОН током силой 6 А, чтобы получить 1,88 л кислорода? (Условия нормальные).
Решение: Так как продукт электролиза является газом, представим объединённое уравнение закона Фарадея в виде:
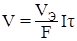 ,
,
где V– объём выделившегося газа, л; VЭ – эквивалентный объём, л/моль.
При нормальных условиях эквивалентный объём кислорода V0Э = 5,6 л/моль. Отсюда необходимо время электролиза
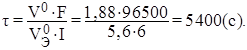 τ=5400 с=90 мин.
τ=5400 с=90 мин.
