Типы окислительно-восстановительных реакций
1. Реакции диспропорционирования (самоокисления - самовосстановления), в них один и тот же элемент выступает в качестве окислителя и восстановителя.
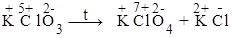
| Cl5+ + 6ē ® Cl¯ Cl5+ - 2ē ® Cl7+ | 1 окислитель 3 восстановитель |
4KClO3 = 3KClO4 + KCl
2. Реакции контрдиспропорционирования, в которых один и тот же элемент, в разных степенях окисления, окисляется и восстанавливается до элемента в одной и той же степени окисления
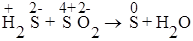
| S4+ + 4ē ® S0 S2- -2ē ® S0 | 1 окислитель 2 восстановитель |
2H2S + SO2 = 3S + 2H2O
3. Реакции внутримолекулярного окисления и восстановления, реакции в которых окислитель и восстановитель входят в состав одного и того же соединения.
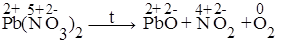
| N5+ + 1ē ® N4+ 2O2- - 4ē ® O2 | 4 окислитель 1 восстановитель |
2Pb(NO3)2 ® 2PbO + 4NO2 + O2
Направленность окислительно-восстановительных реакций
Возможность самопроизвольного протекания окислительно-восстановительной реакции при стандартных условиях определяется по стандартным окислительно-восстановительным потенциалам окислителя и
восстановителя (приложение 2). Данные значения потенциалов для полуреакций приводятся в справочниках. Реакция считается возможной при положительной разности потенциалов между окислителем и восстановителем: Е0окислит. -Е0восстан. > 0
При разности потенциалов больше 0,4 В реакция протекает практически необратимо.
Свободная энергия Гиббса DG связана со стандартным потенциалом следующей зависимостью:DG = -nFE0 , где F – число Фарадея (96500 Кл/моль), n - число отданных или принятых электронов.
Пример 3:
K+MnO4¯ + Na+NO2¯ + H2+SO42─ ® Mn2+SO42─ + Na+NO3¯ + H2O
| MnO4¯+8H+ +5ē ® Mn2+ + 4H2O NO2¯ + H2O-2ē ® NO3¯ + 2H+ | 2 окислитель Е0 = +1,53 В 5 восстановитель Е0=+ 0,84 В |
2KMnO4+5NaNO2+3H2SO4=2MnSO4 +5NaNO3 + K2SO4 + 3H2O
Е0окислит. -Е0восстан = 1,53 – 0,84 = 0,69 В
Данная реакция будет протекать при стандартных условиях.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. В каком из указанных веществ бром может быть только восстановителем:
| 1) Br2 | 2) KBrO | 3) KBr | 4) KBrO2 | 5) KBrO3 |
В каком из указанных веществ марганец может быть только окислителем:
| 1) Mn | 2) MnO2 | 3) KMnO4 | 4)K2MnO4 | 5) MnCl2 |
2. Какая из указанных реакций относится к окислительно-восстановительной:
1) H2S + HNO3 → H2SO4 + NO + H2O
2) Na2CO3 + HCl → NaCl + H2O + CO2
3) SbCl3 + H2O → SbOHCl2 + HCl
4) Bi(OH)3 + HNO3 → Bi(NO3)3 + H2O
5) H2S + ZnCl2 → ZnS + HCl
3. Составьте уравнение окислительно-восстановительной реакции методом электронного баланса:
1) K2S + KMnO4 + H2SO4 ® S + K2SO4 + MnSO4 + H2O
2) As + HNO3(конц) ® H3AsO4 + NO2 + H2O
3) KClO3 + MnO2 + KOH ® K2MnO4 + KCl + H2O
4) Sn + HNO3 (разб.) → Sn(NO3)2 + N2O + H2O
4. Расставьте коэффициенты в окислительно-восстановительной реакции методом полуреакций, укажите окислитель и восстановитель, определите направленность процесса
K2Cr2O7 + KCl + H2SO4 → Cl2 + Cr2(SO4)3 + K2SO4 + H2O
5. В какой из приведенных реакций сильнее выражены окислительные свойства (исходя из φо):
1) 
2) 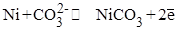
3) 
4) 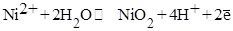
5) 
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование:штативы, пробирки, набор реактивов в капельницах и бюксах.
Опыт 1. Окислительные свойства перманганата калия в различных средах
Налейте в первую пробирку 5-6 капель перманганата калия, добавьте 5-6 капель серной кислоты и внесите на кончике шпателя сульфит натрия. Встряхните пробирку. Отметьте изменение окраски в первой пробирке. Напишите уравнение окислительно-восстановительной реакции.
Налейте во вторую пробирку 5-6 капель перманганата калия, добавьте 1 мл воды и внесите полшпателя сульфита натрия. Резко встряхните пробирку 2 раза и подержите ее в руке, наблюдая за протеканием реакции. Отметьте изменение окраски во второй пробирке. Напишите уравнение окислительно-восстановительной реакции.
Налейте в третью пробирку 5-6 капель перманганата калия, добавьте 1 мл раствора гидроксида калия и внесите на кончике шпателя сульфит натрия. Осторожно легко встряхните пробирку и поставьте ее в штатив. Отметьте изменение окраски в третьей пробирке. Напишите уравнение окислительно-восстановительной реакции.
Опыт 2. Окислительные свойства дихромата калия в кислой среде
Налейте в пробирку 5-6 капель раствора бихромата калия, добавьте столько же капель серной кислоты, внесите полшпателя порошка сульфата железа (II) (соль Мора) и встряхивайте пробирку до образования устойчивой зеленой окраски. Напишите уравнение окислительно - восстановительной реакции.
Опыт 3. Окислительные свойства йода (нейтральная реакция среды)
Внесите в пробирку 5-6 капель йода и добавьте 1 шпатель сульфита натрия. Наблюдайте обесцвечивание раствора. Напишите уравнения окислительно-восстановительной реакции.
Опыт 4. Окислительные и восстановительные свойства пероксида водорода
Внесите в 1 пробирку 5-6 капель перманганата калия, 2-3 серной кислоты, и несколько капель пероксида водорода. Наблюдайте выделение газа. Внесите во 2 пробирку 5-6 капель иодида калия, 2-3 капли серной кислоты, и 5-6 капель перекиси водорода. Выделение йода определите, прибавив 1-2 каплю крахмала (или экстрагировав его гексаном). Напишите уравнения реакций.
Лабораторная работа № 8
ЭЛЕКТРОЛИЗ
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
