Подставив в математическое выражение константы значения равновесных концентраций веществ, определим
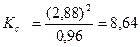
Для определения направление смещения равновесия используют принцип Ле Шателье: если на систему, находящуюся в равновесии, оказано внешнее воздействие (изменены температура, давление и др.), то происходит сдвиг равновесия в том направлении, которое ослабляет эффект этого воздействия. Сдвиг равновесия приводит к изменению равновесного состава.
В данном примере нужно проанализировать сдвиг равновесия при изменении давления. Смещение равновесия путем изменения давления существенно только в системах с участием газов и пренебрежимо мало для кондесированных (жидких и твердых) систем. При повышении давления (увеличения числа моль газа в единице объема) равновесие смещается в сторону уменьшения числа моль газов и уменьшения числа моль газов в единице объема. Наоборот, при уменьшении давления равновесие сдвигается в сторону увеличения числа моль газов (при постоянном объеме – в сторону увеличения давления). Т.о. в нашей системе равновесие при уменьшении давления сдвигается в направлении образования СО за счет реакции СО2 с графитом, т.к. в данной реакции число моль газа увеличивается ( Dn=2 – 1 =1).
Пример 4. Для реакции
2 С(графит) + Н2(г) = С2Н2(г), DH0х.р. =226,75 кДж.
1. Написать математическое выражение константы равновесия Кс.
2. Указать, как влияет на концентрацию ацетилена в равновесной смеси:
а) повышение температуры; б) увеличение давления (T=const);
в) увеличение весового количества графита; г) введение катализатора.
Решение:
1. Реакция синтеза ацетилена является гетерогенным процессом и протекает на границе раздела твердой и газообразной фазы. Концентрация твердой фазы – графита является постоянной величиной, и константа равновесия данной реакции представляет собой отношение равновесных концентраций ацетилена и водорода:
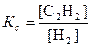 ;
;
2. Качественно направление смещение равновесия при изменении одного из условий равновесия определяется принципом Ле Шателье (см. пример 3):
а) данная реакция является эндотермическим процессом (DH0>0), подвод тепла извне компенсируется его поглощением в эндотермическом процессе, и равновесие смещается в направлении протекания прямой реакции, что приведет к увеличению концентрации ацетилена в равновесной смеси;
б) увеличение давления приводит к увеличению молярной концентрации газообразных веществ (водорода и ацетилена), т.о. концентрация ацетилена возрастает, хотя смещения равновесия не происходит, так как протекание данной реакции не сопровождается изменением числа моль газов Dn=0;
в) данная система является гетерогенной; константа равновесия Кс не включает в себя твердую фазу, поэтому весовое количество графита не влияет на величину концентрации ацетилена;
г) введение катализатора сокращает время достижения равновесия, но не влияет на его смещение. Следовательно, равновесная концентрация ацетилена в присутствии катализатора остается постоянной.
Пример 5. Для реакции Ag2O(к) = 2Ag(к) + 0,5O2(г), DH0х.р= 31,15 кДж
1. Написать математические выражения для Кс и Кр и сравнить совпадают ли они численно?
2. В сторону расходования или образования кислорода сдвигается равновесие при: а) уменьшении давления; изменится ли при этом концентрация кислорода; б) увеличение температуры; изменится ли при этом концентрация кислорода в) увеличение весового количества Ag2O?
Решение:
1.Т.к. реакция гетерогенная, то константа равновесия не включает в себя концентрации и давление твердых фаз: Кс=[O2]0,5, Кр= 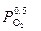 , Кр=Кс(RT)Dn=Кс(RT)0,5.
, Кр=Кс(RT)Dn=Кс(RT)0,5.
- а) По принципу Ле Шателье (см. примеры 3 и 4) равновесие сместится при уменьшении давления в сторону разложения Ag2O(к) и образования кислорода, однако, т.к. Кс=const при Т=const и не зависит от общего давления, концентрация кислорода останется прежней из-за возрастания общего объема системы при уменьшении давления;
б) Ввиду эндотермичности процесса, равновесие с ростом температуры сдвинется в сторону разложения оксида серебра и накопления кислорода в системе. Кс эндотермических реакций с ростом температуры возрастает, поэтому равновесная концентрация кислорода также возрастает;
в) Т.к. концентрация оксида серебра не входит в выражении константы равновесия, то увеличение весового его количества на равновесие не влияет.
Задачи
41. Равновесие в гетерогенной системе С(графит) + 2 Cl2(г) = CCl4(г) установилось при следующих концентрациях реагирующих веществ (моль/л): [Cl2] = 0,8, [CCl4] =0,3. Рассчитать начальную концентрацию хлора. В каком направлении сместится равновесие в данной системе при увеличении давления?
42. Равновесие в гомогенной системе N2(г) + 3 H2(г) = 2 NH3(г) установилось при следующих концентрациях (моль/л): [N2] = 11; [H2] = 2; [NH3] =3. Вычислить константу равновесия (Кс) и исходные концентрации азота и водорода. В каком направлении сместится равновесие данной реакции при увеличении давления?
43. Равновесие в гомогенной системе 4HCl(г) +O2(г)=2H2O(г)+ 2Cl2(г) установилось при следующих концентрациях (моль/л): [HCl] = 0,25; [O2] =0,3; [H2O] = 0,2; [Cl2] =0,2. Вычислить константу равновесия (Кс) и исходные концентрации HCl и О2. В каком направлении сместится равновесие в данной сиcтеме при уменьшении общего давления?
44. Константа равновесия реакции H2(г) + I2(г) = 2HI(г), DH0х.р.=51,8 кДж, Кс = 50. Равновесные концентрации водорода и иода (моль/л) соответственно составляют 1 и 6. Рассчитать начальные концентрации водорода и иода. Какие факторы будут способствовать увеличению равновесной концентрации продукта реакции?
45. Для реакции 2NО2(г) = 2NO(г) + O2(г) рассчитать исходную концентрацию NO2 и константу равновесия (Кс), если равновесие установилось при следующих концентрациях (моль/л): [NO2] =0,2; [NO] = 0,6; [O2] = 0,3. В каком направлении сместится равновесие в данной реакции при увеличении давления в системе? Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
46. Равновесие в гетерогенной системе С(графит) + СО2(г) = 2 CО(г) установилось при следующих концентрациях реагирующих веществ (моль/л): [CО2] = 0,6, [CO] = 0,4. Вычислить исходную концентрацию СО2 и константу равновесия Кс. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
47. Константа равновесия реакции С(графит) + 2 Н2(г) = CН4(г) при некоторой температуре Кс=21,3. Рассчитать исходную концентрацию водорода, если равновесная концентрация метана равна 0,1 моль/л. В каком направлении сместится равновесие в данной системе при уменьшении давления?
48. Исходные концентрации CO и Cl2, участвующих в реакции СО(г) + Cl2(г) = CОCl2(г), равны 1 моль/л . Рассчитать равновесные концентрации реагирующих веществ, если к моменту равновесия прореагировало 60% первоначального количества СО. Записать математическое выражение для Кр и Кс и определить совпадают ли они численно.
49. Разложение метана протекает по уравнению:
2CH4(г) = C2H2(г) + 3H2(г). Рассчитайте исходную концентрацию метана, если равновесие установилось при следующих концентрациях реагирующих веществ (моль/л): [CH4] = 0,2; [H2] = 0,3; [C2H2] = 0,1. В каком направлении сместится равновесие в данной реакции при уменьшении объема системы? Записать математическое выражение для Кр и Кс и определить совпадают ли они численно.
50. Дано уравнение реакции H2(г) + I2(г) = 2 HI(г). Сколько HI образуется к моменту равновесия из 2 моль H2 и 1 моль I2, если Кс = 50. В каком направлении сместится равновесие при увеличении давления в системе? Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
51. Реакция разложения диоксида азота протекает по уравнению 2NO2(г) = 2 NO(г) + O2(г). Вычислить равновесные концентрации реагирующих веществ, если исходная концентрация NO2 равна 4 моль/л, а к моменту равновесия прореагировало 60% от его первоначального количества. В каком направлении сместится равновесие в данной реакции при увеличении давления в сиcтеме? Записать математическое выражение для Кр и Кс и определить совпадают ли они численно.
52. Рассчитать константу равновесия (Кс) реакции N2(г) + 3H2(г)= 2NH3(г), если исходные
концентрации N2 и H2 соответственно равны 0,4 и 2,24 моль/л и к моменту равновесия прореагировало 20% исходного количества азота. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
53. Рассчитать Кс реакции N2O4(г) = 2 NO2(г), если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту равновесия прореагировало 50% N2O4. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
54. Константа равновесия (Кс) реакции: СО2(г) + Н2(г) = СО(г) + Н2О(г) при некоторой температуре равна 1. Определить равновесные концентрации реагирующих веществ, если исходные концентрации СО2 и Н2 составляли соответственно 1 и 5 моль/л. Влияете ли изменение давления на смещение равновесия реакции? Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
55. Рассчитать Кс реакции 2SO2(г) + O2(г) = 2SO3(г), если начальные концентрации SO2 и O2 (моль/л) соответственно равны 2 и 4 и к моменту равновесия прореагировало 25% исходного количества SO2. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
56. Рассчитать Кс реакции CO(г) + Cl2(г) = COCl2(г), если из 2 моль СО и 2 моль Cl2 образовалось к моменту равновесия 0,45 моль COCl2. В каком направлении сместится равновесие в данной реакции при уменьшении объема системы? Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
57. Рассчитать Кс реакции 2H2(г) + S2(г) = 2 H2S(г), если исходные концентрации H2 и S2 составляют соответственно 4 и 3 моль/л и к моменту равновесия прореагировало 70% исходного количества Н2. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
58. Для реакции H2(г) + Br2(г) = 2 HBr(г) константа равновесия при некоторой температуре Кс=1. Определить равновесные концентрации реагентов, если исходная смесь состояла из 3 молей водорода и 1 моля брома ( общий объем системы 1 л). Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
59. Рассчитать константу равновесия (Кс) для реакции PCl5(г) = PCl3(г) + Cl2(г), если к моменту равновесия прореагировало 54% PCl5, исходная концентрация которого составляла 2 моль/л. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
60. При некоторой температуре равновесие в системе 2NO2(г) = 2NO(г) + O2(г) установилось при следующих концентрациях: [NO2] = 0,06 моль/л; [NO] = 0,24 моль/л; [O2] = 0,12 моль/л. Найти константу равновесия (Кс) реакции и исходную концентрацию NO2. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
61. Константа равновесия (Кс) реакции FeO(к) + CO(г) = Fe(к) + CO2(г) при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если исходная концентрация СО составляла 0,8 моль/л. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
62. Рассчитать равновесные концентрации веществ и константу равновесия Кс для реакции С2Н6(г) = С2Н4(г) + Н2(г), если исходная концентрация этана составляла 2 моль/л и к моменту равновесия прореагировало 50% исходного количества. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
63. Для реакции 2Fe(к) + 3 H2O(г) = Fe2O3(к) + 3H2(г), DH0х.р. =35,4 кДж.
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) указать, как влияют на концентрацию водорода в равновесной смеси: а) увеличение давления; б) увеличение концентрации водяного пара?
64. Для реакции CaCO3(к) = CO2(г) + CaO(к), DH0х.р. =277,4 кДж
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) Указать, как влияют на концентрацию диоксида углерода в равновесной смеси: а) увеличение температуры; б) уменьшение давления?
65. Для реакции 4HCl(г) + O2(г) = 2 H2O(г) + 2Cl2(г), DH0х.р. =-88 кДж;
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) Указать, в каком направлении сместится равновесие при: а) увеличении давления; б) увеличении концентрации водяного пара; в) введении катализатора?
66. Для реакции Ag2O(к) = 2Ag(к) + 0,5O2(г), DH0х.р.= 31,15 кДж
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) В сторону расходования или образования кислорода сдвигается равновесие при: а) уменьшении давления; б) увеличении температуры; в) увеличении весового количества Ag2O?
67. Для реакции Fe2O3(к) + 3H2(г) = 2Fe(к) + 3H2O(г), DH0х.р.=-35,4 кДж
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) Указать, как влияют на концентрацию водяного пара в равновесной смеси: а) повышение температуры; б) увеличение концентрации водорода; в) введение катализатора.
68. Для реакции C(графит) + CO2(г) = 2CO(г), DH0х.р.=172,6 кДж
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) Указать, как влияет на концентрацию оксида углерода (IV); а) повышение давления; б) увеличение весового количества графита; в) увеличение концентрации оксида углерода (II).
69. Для реакции C(графит) + 2H2(г) = CH4(г), DH0х.р. = -74,86кДж
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) Указать, как влияет на концентрацию метана в равновесной смеси: а) повышение температуры; б) увеличение концентрации водорода; в) введение катализатора.
70. Для реакции С(графит) + О2(г) = СО2(г), DH0х.р. = -393,8 кДж,
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) Указать, в каком направлении смещается равновесие в системе при: а) нагревании; б) увеличении весового количества графита; в) увеличении концентрации кислорода.
71. Для реакции синтеза аммиака N2(г) + 3H2(г) = 2NH3(г), DH0х.р. = -92,4 кДж
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) В сторону расходования или образования аммиака сдвигается равновесие при: а) увеличении давления; б) увеличении концентрации водорода; в) введении катализатора.
72. Для реакции 2N2O(г) = 2N2(г) + O2(г), DH0х.р. <0
1) Написать математическое выражение константы равновесия Кс; 2) В сторону расходования или образования кислорода сдвигается равновесие при: а) увеличении
температуры; б) уменьшении общего объема смеси; в) увеличении концентрации азота.
73. Для реакции СаО(к) + 3С(графит) = СаС2(к) + СО(г), DH0х.р. <0
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) В сторону расходования или образования СО сдвигается равновесие при: а) введении катализатора; б) увеличении давления; в) понижении температуры.
74. Для реакции BaO(к) + CO2(г) = BaCO3(г), DH0х.р. <0
1) Написать математические выражения константы равновесия Кс и Кр и установить
взаимосвязь между ними;
2) В сторону расходования или образования углекислого газа сдвигается равновесие при: а) увеличении давления; б) повышении температуры.
75. Для реакции Fe(к) + 0,5 O2(г) = FeO(к), DH0х.р. <0
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) В сторону расходования или образования кислорода сдвигается равновесие при: а) увеличении общего объема системы; б) понижении температуры.
76. Для реакции SO2Cl2(г) = SO2(г) + Cl2(г) DH0х.р.>0
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) В сторону расходования или образования хлора сдвигается равновесие при: а) увеличении концентрации диоксида серы;
б) увеличении температуры; в) введении катализатора.
