Повышение температуры кипения и понижение температуры кристаллизации раствора. Эбуллиоскопия и криоскопия
Кипение представляет собой фазовый переход, при котором происходит превращение жидкости в пар, причем пузырьки пара образуются во всем объеме жидкости. Температурой кипения жидкости называют ту температуру, при которой давление насыщенного пара над данной жидкостью равно внешнему. При этой температуре и соответствующем ей давлении насыщенного пара устанавливается равновесие между жидкой и газообразной фазами (скорость испарения равна скорости обратного процесса — конденсации) и обе эти фазы могут сосуществовать в течение длительного времени. Если жидкость — индивидуальное вещество и внешнее давление не меняется, то кипение ее в открытом сосуде происходит при постоянной температуре до тех пор, пока полностью не исчезнет жидкая фаза. Температура, при которой данная жидкость кипит в условиях давления 101 325 Па, называют нормальной температурой кипения,
Замерзание (затвердевание) представляет собой фазовый переход, при котором происходит превращение жидкости в твердое вещество, частицы которого (кристаллы) образуются во всем объеме жидкости.
Температурой замерзания (кристаллизации) жидкости называют ту температуру, при которой давление насыщенного пара над жидкостью равно давлению насыщенного пара над выпадающими из нее кристаллами твердой фазы. При этой температуре и соответствующем ей давлении насыщенного пара устанавливается равновесие между жидкой и твердой фазами (скорость кристаллизации равна скорости плавления) и обе эти фазы могут сосуществовать в течение длительного времени. Если жидкость — индивидуальное вещество и внешнее давление остается постоянным, то при ее охлаждении температура будет оставаться постоянной, соответствующей температуре замерзания, до тех пор, пока не произойдет полное затвердевание.
Для того, чтобы сместить равновесие в сторону кристаллизации надо понизить температуру, т.к. кристаллизация – это экзотермический процесс. Если растворить в жидкости какое-то вещество, концентрация ее уменьшится и в системе жидкость – твердая фаза усилится процесс плавления. Отсюда вытекает зависимость (II закон Рауля):
Повышение температуры кипения, а также понижение температуры кристаллизации разбавленных растворов прямо пропорционально моляльности раствора и не зависит от природы вещества.
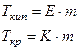 где
где
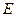 -эбуллиоскопическая константа (зависит от природы растворителя, не зависит от природы вещества и концентрации)
-эбуллиоскопическая константа (зависит от природы растворителя, не зависит от природы вещества и концентрации)
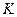 - криоскопическая константа (зависит от природы растворителя, не зависит от природы вещества и концентрации)
- криоскопическая константа (зависит от природы растворителя, не зависит от природы вещества и концентрации)
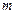 - моляльность раствора
- моляльность раствора
Эбуллиоскопическая и криоскопическая константы численно равны тому повышению температуры кипения или, соответственно, понижению температуры кристаллизации раствора, которое наблюдалось бы при растворении в 1000 г растворителя 1 моль какого-либо вещества, если бы сохранилась прямая пропорциональность между указанными изменениями температур кипения и кристаллизации и моляльностью растворенного вещества, имеющая место в области разбавленных растворов, вплоть до моляльности 1 моль/кг.
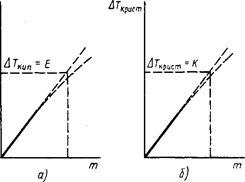
Рис.18.2. К объяснению физического смысла эбуллиоскопической (а) и криоскопической (б) констант
Закон Рауля лежит в основе экспериментальных методов определения молярных масс растворенных веществ, путем наблюдения вызываемого ими повышения точки кипения (эбуллиоскопическая) или понижения точки замерзания (криоскопия) растворителя. Нередко методы эбуллиоскопии и криоскопии применяют с целью определения степени электролитической диссоциации или степени ассоциации (полимеризации) веществ, изотонический коэффициент Вант-Гоффа для которых не равен единице. Методы эбуллиоскопии и криоскопии широко используются при физико-химическом изучении биологических объектов.
- Раствор, содержащий 5 г вещества неэлектролита в 100 г воды, кипит при 100,430С. Е(Н2О)=0,52. Определить молярную массу неэлектролита.
