Общая характеристика растворов.
Лекция №3. РАСТВОРЫ
План
1. Общая характеристика растворов.
2. Способы выражения концентрации растворов.
3. Термодинамика и механизм процесса растворения.
4. Растворимость.
5. Вода как растворитель. Значение растворов в жизнедеятельности организмов.
6. Коллигативные свойства растворов.
Общая характеристика растворов.
Растворы – это гомогенные системы переменного состава, включающие два и более компонентов. Частицы компонентов раствора распределены по его объему в виде атомов, молекул или ионов (размер частиц 0,1 – 0,5 нм).
Образование растворов, в отличие от механических смесей, сопровождается изменением энтальпии, энтропии и объема системы.
По агрегатному состоянию различают газовые, жидкие и твердые растворы. Но обычно термин растворы относится к жидким системам.
Способы выражения концентрации растворов.
Относительное содержание компонентов в растворе определяется его концентрацией.
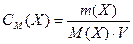 |
Молярная концентрация – это количество вещества, содержащееся в одном литре раствора (моль/л):
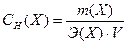 |
Эквивалентная концентрация – это число молей эквивалентов вещества, содержащихся в одном литре раствора (моль/л):
Эквивалент – это реальная или условная частица вещества, которая в кислотно-основной реакции эквивалентна одному иону водорода, а в окислительно-восстановительной эквивалентна одному электрону.
Масса одного моля эквивалентов называется молярной массой эквивалента вещества (Э). В разных реакциях одно и то же вещество может иметь разные эквиваленты.
Моляльная концентрация – это количество вещества, содержащееся в одном килограмме растворителя (моль/кг):
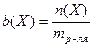 |
Массовая доля равна отношению массы растворенного вещества к массе раствора:
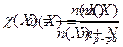 |
Молярная доля равна отношению количества растворенного вещества в общему количеству веществ в растворе:
Как правило, вещество обладает определенной растворимостью в данном растворителе. Под растворимостью понимают концентрацию вещества в насыщенном растворе.
Растворимость
Под растворимостью понимают концентрацию растворенного вещества в насыщенном растворе.
Растворимость выражают в тех же единицах, что и концентрацию. Часто используют коэффициент растворимости s, равный массе растворенного вещества (г) в насыщенном растворе, содержащем 100 г растворителя.
Насыщенным называют раствор, который находится в равновесии с избытком растворяемого вещества (DGр-ния=0). Насыщенный раствор имеет максимально возможную в данных условиях концентрацию.
Растворимость зависит:
- от природы растворенного вещества и растворителя;
- от температуры;
- от давления;
- от присутствия третьих компонентов.
Влияние природы компонентов на растворимость определяется принципом: подобное растворяется в подобном. Полярные растворители, например, вода, хорошо растворяют вещества с ионной связью (неорганические соли, кислоты и основания). Хорошей растворимостью в воде обладают полярные органические соединения, образующие с молекулами растворителя водородные связи (спирты, карбоновые кислоты, амины). Неполярные растворители, например, углеводороды, растворяют неполярные и малополярные соединения (жиры).
Влияние температуры на растворимость зависит от теплового эффекта растворения и определяется принципом Ле Шателье. Повышению растворимости газов способствует понижение температуры, так как растворение газов – процесс экзотермический. Растворимость большинства твердых веществ и жидкостей - процесс эндотермический и возрастает при повышении температуры.
Влияние давления существенно только в том случае, если при растворении происходит значительное изменение объема системы, что наблюдается при растворении газов в жидкостях. Растворимость газов растет с увеличением давления, так как сопровождается уменьшением объема системы.
Закон Генри:
Количество газа, растворенного в определенном объеме жидкости при постоянной температуре прямо пропорционально давлению газа.
c(X) = Kг p(X)
где c(X) – молярная концентрация газа,моль/л
Kг - константа Генри, моль/лžПа
p(X) – давление газа над раствором, Па
Влияние присутствия третьих компонентов.
Растворимость газов в жидкостях значительно снижается в присутствии электролитов (солей) Этот процесс называют высаливанием.
Закон Сеченова:
Растворимость газов в жидкостях в присутствии электролитов понижается.
С(X) = С0(X)ž 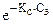
где С(X) – растворимость газа в присутствии электролита
С0(X) – растворимость газа в чистом растворителе
КС - константа Сеченова
Сэ - концентрация электролита
Биологическое значение законов Генри и Сеченова.
Изменение растворимости газов в крови при изменении давления может привести к тяжелым заболеванием. Кесонная болезнь у водолазов – проявление закона Генри. В соответствии с законом Сеченова растворимость кислорода и углекислого газа в крови зависит от концентрации электролитов, а также белков, липидов и других веществ.
Лекция №3. РАСТВОРЫ
План
1. Общая характеристика растворов.
2. Способы выражения концентрации растворов.
3. Термодинамика и механизм процесса растворения.
4. Растворимость.
5. Вода как растворитель. Значение растворов в жизнедеятельности организмов.
6. Коллигативные свойства растворов.
Общая характеристика растворов.
Растворы – это гомогенные системы переменного состава, включающие два и более компонентов. Частицы компонентов раствора распределены по его объему в виде атомов, молекул или ионов (размер частиц 0,1 – 0,5 нм).
Образование растворов, в отличие от механических смесей, сопровождается изменением энтальпии, энтропии и объема системы.
По агрегатному состоянию различают газовые, жидкие и твердые растворы. Но обычно термин растворы относится к жидким системам.
