История развития представлений о механизмах биологического окисления.
Перекисная теория А.Н.Баха. В 1896-1897 гг. русский ученый А.Н. Бах сформулировал теорию медленного окисления, согласно которой молекулярный кислород активируется с помощью ненасыщенной органической молекулы, при этом образуется пероксид этого соединения. Возникшие пероксиды органических соединений, как и пероксид водорода, могут окислять другие вещества при каталитическом воздействии пероксидазы.
Теория биологического окисления В.И. Палладина. В 1912 г. Палладин В.И впервые высказал идею о том, что биологическое окисление есть перенос водорода от окисляемого вещества навстречу кислороду с образованием воды в качестве конечного продукта. Ученый выделил две фазы биологического окисления: 1-ая фаза - анаэробная, протекает без участия кислорода, на этом этапе водород от органических молекул передается на промежуточные переносчики; вторая фаза - аэробная, протекает с участием кислорода, на этом этапе водород от промежуточных переносчиков передается на кислород с образованием воды:
1-ая фаза: SH2 + R↔ S+ RH2 2-ая фаза: RH2 + ½ O2 → H2O + R
Концепция Палладина В.И. быстро получила подтверждение: были выделены и охарактеризованы разнообразные дегидрогеназы - ферменты, ускоряющие реакции окисления органических молекул (SH2) с участием различных коферментов - по теории Палладина В.И. – промежуточных переносчиков водорода (R).
Современные представления о биологическом окислении.Химические реакции, в процессе которых происходит перенос электронов от одной молекулы к другой, называютсяокислительно-восстановительными реакциями.Соединения, отдающие электроны в такой реакции, называютсядонорами электронов,а соединения, присоединяющие электроны, -акцепторами электронов или окислителями.В общем виде окислительно-восстановительную реакцию можно написать:
Донор электронов ↔ е- + Акцептор электронов
Способы передачи электронов от одной молекулы к другой:
I. Прямой перенос электронов.
Например, окислительно-восстановительная пара Fe2+ и Fe3+ :
Fe2+ ↔ е- + Fe3+
II. Перенос электронов в составе атомов водорода(дегидрирование). Напомним, что атом водорода состоит из протона (Н+) и электрона (е-). В этом случае общее уравнение имеет вид:
ВН2 + А ↔ В+ АН2 ,
где ВН2 – донор водорода (ВН2 ↔ В+ 2е- + 2Н+ ), А – акцептор водорода.
III. Перенос электронов путем прямого взаимодействия органического восстановителя с кислородом. В результате образуется продукт, в котором содержится ковалентно связанный кислород. Например, введение в состав органической молекулы атома кислорода с образованием гидроксильной группы:
R–CH3 + ½ О2 ↔ R–CH2–OH. В этой реакции донором электронов является органическая молекула, а атом кислорода играет роль акцептора.
Согласно современной теории биологического окисления все окислительно-восстановительные реакции катализируются ферментами класса оксидоредуктаз. Все оксидоредуктазы относятся к сложным ферментам, т.е. содержат белковую часть – апофермент и небелковую часть – кофермент. Именно кофермент в составе оксидоредуктазы служит промежуточным переносчиком электронов/водорода от донора к акцептору в ходе окислительно-восстановительной реакции.
Выделяют два типа биологического окисления:
I. Свободное окисление, при котором свободная энергия, высвобождающаяся при окислении органических молекул, переходит в тепловую энергию и рассеивается. К таким реакциям относятся реакции: микросомального окисления, генерации активных форм кислорода и антиоксидантной защиты.
II. Окисление, сопряженное с фосфорилированием АДФ и синтезом АТФ. Этот тип биологического окисления осуществляется в электронтранспортной цепи (дыхательной цепи), локализованной во внутренней мембране митохондрий или сопряжен с фосфорилированием АДФ на уровне субстрата.
Цикл трикарбоновых кислот (ЦТК), цикл Кребса или цикл лимонной кислоты является общим этапом катаболизма углеводов, жиров и белков. Сложные молекулы органических веществ превращаются в один общий метаболит – активную форму уксусной кислоты:


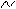 ацетил-коферментА: СН3 – С S-КоА.
ацетил-коферментА: СН3 – С S-КоА.
О
Ацетил-КоА окисляется в ЦТК, который локализуются в матриксе митохондрий. ЦТК включает ряд последовательных реакций:
1.Конденсация ацетил-КоА с оксалоацетатом (щавелевоуксусной кислотой) с образованием цитрата (лимонной кислоты) фермент – цитратсинтаза:
Ацетил-КоА + оксалоацетат + Н2О → цитрат + HS-KoA
6. Митохондрии имеются во всех эукариотических клетках. Эти органеллы — главное место аэробной дыхательной активности клетки. Впервые митохондрии были обнаружены в виде гранул в мышечных клетках в 1850 г.
Синтез АТФ из АДФ и Н3РО4 за счёт энергии переноса электронов по ЦПЭ называют окислительным фосфорилированием. Протонный градиент и электрохимический потенциал Перенос электронов по дыхательной цепи от NADH к кислороду сопровождается выкачиванием протонов из матрикса митохондрий через внутреннюю мембрану в межмембранное пространство. На эту работу затрачивается часть энергии электронов, переносимых по ЦПЭ. Протоны, перенесённые из матрикса в межмембранное пространство, не могут вернуться обратно в матрикс, так как внутренняя мембрана непроницаема для протонов. Таким образом, создаётся протонный градиент, при котором концентрация протонов в межмембранном пространстве больше, а рН меньше, чем в матриксе. Кроме того, каждый протон несёт положительный заряд, и вследствие этого появляется разность потенциалов по обе стороны мембраны: отрицательный заряд на внутренней стороне и положительный - на внешней. В совокупности электрический и концентрационный градиенты составляют электрохимический потенциал ΔμН+ - источник энергии для синтеза АТФ. Так как наиболее активный транспорт протонов в межмембранное пространство, необходимый для образования ΔμН+, происходит на участках ЦПЭ, соответствующих расположению комплексов I, III и IV, эти участки называют пунктами сопряжения дыхания и фосфорилирования. Механизм транспорта протонов через митохондриальную мембрану в пунктах сопряжения недостаточно ясен. Однако установлено, что важную роль в этом процессе играет KoQ. Наиболее детально механизм переноса протонов при участии KoQ изучен на уровне комплекса III. KoQ переносит электроны от комплекса I к комплексу III и протоны из матрикса в межмембранное пространство, совершая своеобразные циклические превращения, называемые Q-циклами. Донором электронов для комплекса III служит восстановленный убихинон (QH2), а акцептором - цитохром с. Цитохром с находится с внешней стороны внутренней мембраны митохондрий; там же располагается активный центр цитохрома с1 с которого электроны переносятся на цитохром с. В мембране существует стационарный общий фонд Q/QH2, из которого каждая молекула QH2 в одном цикле обеспечивает перенос протонов из матрикса в межмембранное пространство и электронов, которые в конечном итоге поступают на кислород. На работу, совершаемую при выкачивании протонов, расходуется часть свободной энергии, которая освобождается при переносе электронов по градиенту редокс-потенциала. Энергия электрохимического потенциала (∆μH+) используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы. Строение АТФ-синтазы и синтез АТФ АТФ-синтаза (Н+-АТФ-аза) - интегральный белок внутренней мембраны митохондрий. Он расположен в непосредственной близости к дыхательной цепи. АТФ-синтаза состоит из 2 белковых комплексов, обозначаемых как F0 и F1.Гидрофобный комплекс F0 погружён в мембрану. Он служит основанием, которое фиксирует АТФ-синтазу в мембране. Комплекс F0 состоит из нескольких субъединиц, образующих канал, по которому протоны переносятся в матрикс. Комплекс F1 выступает в митохондриальный матрикс. Он состоит из 9 субъединиц (Зα, 3β, γ, ε, δ). Субъединицы уложены попарно, образуя "головку"; между α- и β-субъединицами располагаются 3 активных центра, в которых происходит синтез АТФ; γ-, ε-, δ- субъединицы связывают комплекс F1 с F0. Повышение концентрации протонов в межмембранном пространстве активирует АТФ-синтазу. Электрохимический потенциал ΔμH+ заставляет протоны двигаться по каналу АТФ-синтазы в матрикс. Параллельно под действием ΔμH+ происходят конформационные изменения в парах α, β-субъединиц белка F1, в результате чего из АДФ и неорганического фосфата образуется АТФ. Электрохимический потенциал, генерируемый в каждом из 3 пунктов сопряжения в ЦПЭ, используют для синтеза одной молекулы АТФ. Коэффициент окислительного фосфорилирования Окисление молекулы NADH в ЦПЭ сопровождается образованием 3 молекул АТФ; электроны от FAD-зависимых дегидрогеназ поступают в ЦПЭ на KoQ, минуя первый пункт сопряжения. Поэтому образуются только 2 молекулы АТФ. Отношение количества фосфорной кислоты (Р), использованной на фосфорилирование АДФ, к атому кислорода (О), поглощённого в процессе дыхания, называют коэффициентом окислительного фосфорилирования и обозначают Р/О. Следовательно, для NADH Р/О = 3, для сукцината Р/О - 2. Эти величины отражают теоретический максимум синтеза АТФ, фактически эта величина меньше. Каждая митохондрия окружена оболочкой, состоящей из двух мембран; между ними — межмембранное пространство. Отграниченное внутренней мембраной пространство называется матриксом. В матриксе содержатся большая часть ферментов, участвующих в цикле Кребса, протекает окисление жирных кислот, располагаются митохондриальные ДНК,РНК и рибосомы. Внутренняя мембрана образует многочисленные гребневидные складки — кристы, существенно увеличивающие площадь ее поверхности. Наружная мембрана митохондрий имеет маленькие отверстия, образованные специальными белками, через которые могут проникать небольшие молекулы и ионы. Внутренняя мембрана таких отверстий не имеет; на ней, на стороне, обращенной к матриксу, располагаются особые молекулы АТФ-синтазы, состоящие из головки, ножки и основания. При прохождении через них протонов происходит синтез АТФ. В основании частиц, заполняя собой всю толщу мембраны, располагаются компоненты дыхательной цепи. Наружная и внутренняя мембраны в некоторых местах соприкасаются, там находится специальный белок-рецептор, способствующий транспорту митохондриальных белков, закодированных в ядре, в матрикс митохондрии.
Наружная мембрана содержит много белка порина, образующего гидрофильные каналы, которые пропускаю через мембрану неорганические ионы, метаболиты и даже небольшие белки (меньше 10кДа). Также она содержит ферменты: элонгазы (удлиняют молекулы насыщенных жирных кислот), кинуренингидроксилазу, моноаминооксидазу (маркер) и др.
Межмембранное пространство митохондрий содержит аденилатциклазу, нуклеозиддифосфаткиназы.
Внутренняя мембрана высокоспецифична, состоит на 70% из белков, которые выполняют каталитическую (окислительное фосфорилирование) и транспортную функцию. Внутренняя мембрана содержит ферменты: а). цепи окислительного фосфорилирования (цитохромоксидаза – маркер) б). СДГ в). β-оксибутират ДГ; г). карнитинацилтрансферазу, д). карнитинацилтранслоказу.
Внутренняя мембрана на 30% состоит из фосфолипидов, из них 20% приходиться на кардиолипин, который делает мембрану непроницаемой для всех ионов.
Матрикс на 50% состоит из белка и содержит сотни различных ферментов. Это ферменты: а). ЦТК; б). β-окисления жирных кислот; в). аминотрансферазы АСТ, АЛТ; г). глутамат ДГ д). фосфоенолпируваткарбоксилазу е). пируват ДГ. Также матрикс содержит несколько копий митохондриальной ДНК, митохондриальные рибосомы и тРНК.
Электроны, мигрирующие по дыхательной цепи, движутся по сложным траекториям. Особенность их движения состоит в петлеобразных движениях в пределах каждого из ферментативных комплексов дыхательной цепи. В каждый комплекс поступают 4 протона на одну пару электронов.
Комплекс I (F-цикл).Суммарно можно представить, что молекула НАДН вносит 2 электрона в митохондриальную мембрану, еще 2 электрона поступают от FeS-
белков и вместе с 4 протонами из матрикса совместно с 2 молекулами ФМН образуют комплекс ФМН-Н2, который перемещается к внешней поверхности мембраны.
Вблизи от поверхности мембраны комплекс распадается на 2 пары электронов, 4 протона и 2 ФМН.
Следует учитывать, что в комплексе I присутствует одна молекула ФМН, которая успевает 2 раза переместиться поперек мембраны, чтобы перенести 4Н+. Две пары электронов связываются двумя FeS-белками, имеющими более высокий электрохимический потенциал и переносятся к внутренней стороне мембраны к ФМН (одна пара электронов) и коэнзиму Q (вторая пара электронов). ФМН возвращается обратно, а протоны не имеют центров связывания и поэтому покидают мембрану. Участки выброса протонов из мембраны представляют собой 10-14 параллельных а-спиральных участков полипептидный цепей, поднимающихся от ферментативных комплексов перпендикулярно внешней стороне мембраны. Протоны передаются в межмембранное пространство по системе водородных связей, стабилизирующих а-спиральные участки.
Комплекс III (Q-цикл).Через систему FeS-белков 2е" (от комплекса I) переносятся к внутренней поверхности мембраны и с 2 протонами из матрикса взаимодействуют с коэнзимом Q (убихиноном), формируя комплекс QH2;, который представляет собой восстановленный убихинон. Еще одна молекула QH2 формируется в результате взаимодействия 2е" (их переносят в комплекс III цитохромы bj и Ь2), с 2 протонами из матрикса и коэнзимом Q. Убихинон, являясь подвижным переносчиком электронов и протонов, переносит их к внешней митохондриальной мембране, где происходит распад этой молекулы. В области внешней стороны мембраны 2 молекулы QH2, распадаются на 2е", 4 протона и 2 молекулы Q*~ (се-михинона). Электроны перехватывают FeS-белки (они содержат 2 Fe2S2 центра). Протоны покидают мембрану, а 2 молекулы Q' ~ передают 2 электрона цитохро-мам Ь] и Ь2 которые, в свою очередь, переносят их к коэнзиму Q. 2 Молекулы се-михинона (Q'"), передав свои неспаренные электроны цитохромам Ъ и Ь2, превращаются в форму коэнзима Q и возвращаются к внутренней стороне мембраны. Два электрона через FeS-белки мигрируют к цитохрому С. Цитохром Q, в свою очередь, передает электроны цитохрому С, который перемещается по внешней поверхности мембраны и является подвижным переносчиком электронов между III и IV комплексами.
Комплекс IV (О-цикл).В IV комплекс электроны вносит цитохром С. Через цитохромы а и а3 электроны поступают к внутренней поверхности мембраны, где совместно с протонами и молекулой кислорода превращаются в пероксид водорода (Н2О2). Он мигрирует к внешней поверхности мембраны и вновь распадается на кислород, электроны и протоны. Протоны выталкиваются из мембраны, а электроны с помощью цитохромов а и а3 вновь доставляются к внутренней поверхности мембраны где, уже утратив свою высокую энергию, взаимодействуют с кислородом и протонами из матрикса и образуют эндогенную воду. Особенность функционирования IV комплекса состоит в переносе через мембрану только 2-х протонов из матрикса. Это объясняется тем, что два другие протона из 4-х поступающих в IV комплекс расходуются на образование воды.
Протонный цикл - замкнутый процесс перемещения Н+ в митохондриях. Функцией протонного канала является первичное запасание энергии электронов в виде мембранного потенциала с последующим использованием ее для синтеза АТФ, а также для переноса веществ через митохондриальную мембрану (каналы транспортных систем).
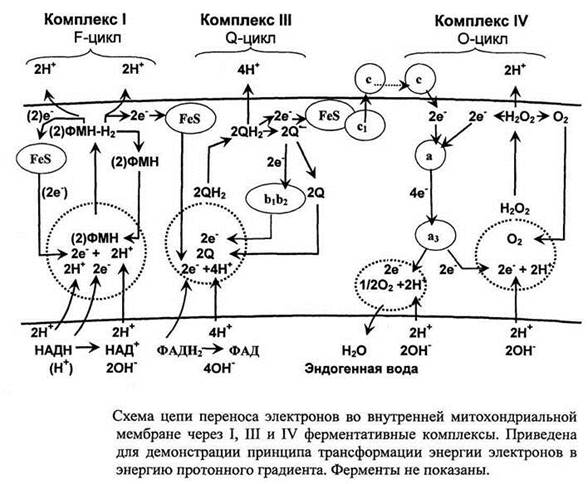
7. АТФ - чрезвычайно важная молекула клетки. Она непрерывно синтезируется и используется. Энергия для синтеза АТФ поступает от субстратов, содержащих высокоэнергетические электроны в ходе их дегидрирования. Электроны высоких энергий извлекаются из субстратов в ходе гликолиза (в цитозоле), при преобразовании пирувата в ацетил-КоА и в цикле трикарбоновых кислот (в митохондриаль-ном матриксе). Молекулы НАДН и ФАДН2 переносят эти электроны в дыхательную цепь, локализованную в во внутренней митохондриальной мембране.
Дыхательная цепь состоит из переносчиков электронов, сгруппированных в 4 ферментативных комплекса, и ферментов. Особенность переносчиков электронов дыхательной цепи в том, что каждый способен принимать электроны от предыдущего и отдавать последующему. Прием и передача электронов молекулами переносчиков происходит упорядоченно в соответствии с их электрохимическими потенциалами. Под электрохимическим потенциалом молекулы понимают её способность вступать во взаимодействие с электроном. Т.е. присоединять электрон и при этом восстанавливаться и отдавать его и при этом окисляться. Электрохимический потенциал молекулы это её способность участвовать в окислительно-восстановительных реакциях. В начало дыхательной цепи электроны вносит НАДН - он обладает самым низким электрохимическим потенциалам. В конце дыхательной цепи находиться кислород - его электрохимический потенциал самый высокий. Электроны, перемещаясь по дыхательной цепи в сторону кислорода, совершают полезную работу по переносу протонов из митохондриалыуого матрикса в межмембранное пространство (рис. 13). На восходящих участках тра-
ектории каждый электрон перемещается вместе с протоном, т.е. в форме атома водорода, затем отделяется от протона на внешней стороне мембраны и продолжает движение внутри мембраны. В межмембранном пространстве накапливаются протоны из митохондриального матрикса. Электрон теряет порции своей энергии на всех участках траектории. На восходящих участках траектории электрон расходует энергию на совершение полезной работы, а на нисходящих участках полезная работа не совершается, хотя электрон также теряет часть своей энергии. 40-45 % энергии электронов используется для создания протонного градиента, который, в свою очередь расходуется на синтез АТФ. 20-25 % энергии электронов используется для транспорта необходимых субстратов. Остальная энергия электронов рассеивается в виде тепла, поэтому митохондрии место теплообразования. Движение электронов по дыхательной цепи создает протонный градиент и значительную трансмембранный электрохимический потенциал между межмембранным пространством и митохондриальным матриксом (его обозначают АцН+ = 0,25 Вольта). ДцН* складывается из ДЧ* = 0,2 Вольта (это электрический потенциал, обусловленный разными зарядами по обе стороны мембраны) и АН+ = 0,05 Вольта (химический потенциал, обусловленный различной концентрацией протонов по обе стороны мембраны).
Энергия этого электрохимического градиента затем используется для синтеза АТФ (её использует АТФ-синтетазный комплекс, комплекс V) и транспорта необходимых субстратов. Эндогенная вода
Эндогенной называется вода, возникающая в клетках в основном при функционировании дыхательных цепей в митохондриях. Некоторое количество эндогенной воды образуется при микросомальном окислении и при разложении пероксида водорода. У взрослого человека в сутки возникает 400^-450 мл эндогенной воды. Каталаза присутствует во всех клетках организма и разлагает пероксид водорода:
Н2О2 + Н2О2 -+ О2 + 2 Н2О
Глутатионпероксидаза также присутствует во всех клетках организма и разлагает пероксид водорода. Содержит селеноцистеин в активном центре.
2 Глутатион-SH + Н2О2 -> Глутатион-SS+ 2Н2ОГлутатионпероксидаза также восстанавливает гидроперикиси липидов. В конце дыхательной цепи электроны взаимодействуют с кислородом и протонами из матрикса и образуется молекулы воды: 4е' + 4Н+ + О2 —» 2Н2О.Особенность образования воды в этой реакции состоит в том, что в неё входят электроны с достаточно низким уровнем энергии. Они уже израсходовали свою значительную энергию на создание протонного градиента. Поэтому роль многочисленных переносчиков электронов, локализованных во внутренней митохонд-риальной мембране, состоит в замедлении взаимодействия высокоэнергетических электронов с кислородом. Если бы их не было, то выделяющаяся тепловая энергия разрушила бы митохондриальную мембрану.
Окисление органических веществ в живых тканях растений и животных происходит с участием ферментов: дегидрогеназ – активаторов и переносчиков водорода (электрона) дыхательного материала и оксидаз – активаторов молекулярного кислорода.
Дегидрогеназы(от де... и новолат. hуdrogenium – водород), ферменты, катализирующие отщепление водорода от органических веществ. Коферментами Д. обычно являются динуклеотиды:
- никотинамидадениндинуклеотид (НАД),
- никотинамидадениндинуклеотидфосфат (НАДФ) или флавинадениндинуклеотид (ФАД)
- флавинмононуклеотид (ФМН), которые акцептируют водород окисляемого вещества. Д. осуществляют первый этап биологического окисления.
Они играют большую роль в цикле Кребса, в гликолизе и в пентозофосфатном цикле. Некоторые Д., не связанные с коферментами, катализируют реакции окисления веществ непосредственно кислородом. Большая часть Д. в составе активного центра содержит металлы – цинк, марганец.
Дегидрогеназы действуют на протяжении всего процесса дыхания и по характеру действия делятся на аэробные и анаэробные. Первые переносят водород непосредственно на молекулярный кислород, а вторые – на какой-либо акцептор водорода. Дегидрогеназы относятся к двухкомпонентным ферментам – протеидам с пиридиновыми или флавиновыми (аллоксазиновыми) коферментами.
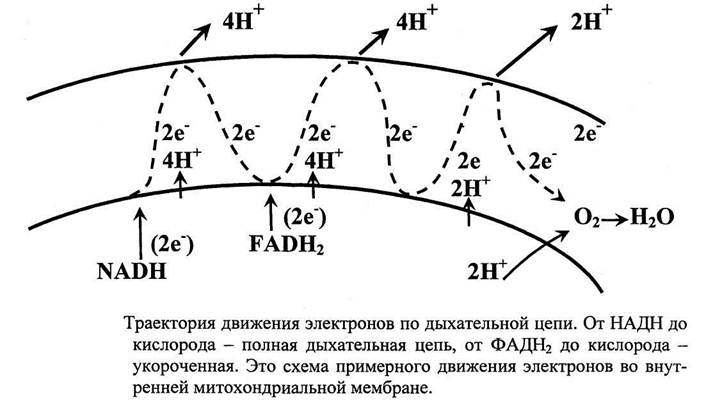
Пиридиновые дегидрогеназы относятся к группе анаэробных дегидрогеназ, которые являются акцепторами водорода субстрата. Специфичность их действия заключается в способности гидрирования и дегидрирования пиридиновых ядер.
Рис. 1 − Пиридин
К флавопротеидным дегидрогеназам относятся ферменты, в состав которых фосфорный эфир рибофлавина.
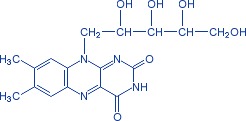
Рис. 2 − Рибофлавин
8.
9.
10.
11. 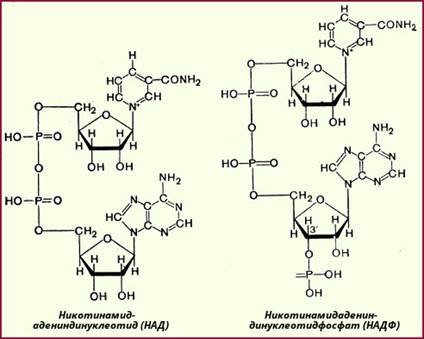 В переносе электронов от субстратов к молекулярному кислороду принимают участие: 1) пиридинзависимые дегидрогеназы, для которых коферментами служат либо НАД, либо НАДФ; 2) флавинзависимые дегидрогеназы (флавиновые ферменты), у которых роль простетической группы играют ФАД или ФМН; 3) цитохромы, содержащие в качестве простетической группы железопорфириновую кольцевую систему. Среди компонентов дыхательной цепи обнаружены также убихинон (коэнзим Q) и белки, содержащие негемовое, или негеминовое, железо.
В переносе электронов от субстратов к молекулярному кислороду принимают участие: 1) пиридинзависимые дегидрогеназы, для которых коферментами служат либо НАД, либо НАДФ; 2) флавинзависимые дегидрогеназы (флавиновые ферменты), у которых роль простетической группы играют ФАД или ФМН; 3) цитохромы, содержащие в качестве простетической группы железопорфириновую кольцевую систему. Среди компонентов дыхательной цепи обнаружены также убихинон (коэнзим Q) и белки, содержащие негемовое, или негеминовое, железо.
