Замена аминокислоты на поверхности гемоглобина А
В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались 2 β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают "слипаться", образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок "замаскирован" в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина S друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение рН, условия высокогорья, полёт на самолёте).
Так как "серповидные" эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли "даже некроз клеток в данной области.
Серповидно-клеточная анемия - гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина. После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.
Гетерозиготные индивидуумы, имеющие один нормальный ген НЬА, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются.
Для диагностики наличия HbS в эритроцитах человека используют метод электрофореза, основанного на движении заряженных белков в электрическом поле. Так как в HbS отрицательно заряженные группы глутамата в β-цепях заменены незаряженным валином, HbS в щелочной среде будет двигаться медленнее, чем НЬА.
Серповидно-клеточная: анемия - первый описанный пример молекулярной болезни.
Почти все встречающиеся замены аминокислот на поверхности молекулы гемоглобина безвредны. Гемоглобин S - редкое исключение.
Биосинтез гема. Схема процесса, химизм первых двух реакций, место протекания. Регуляция активности ферментов АЛК-синтазы и АЛК-дегидратазы. Источники железа для синтеза гема, всасывание железа, транспорт в крови, депонирование.
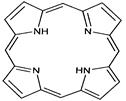
Гемоглобин – это сложный белок, простетической группой которого является гем. Основная роль гемоглобина – перенос кислорода и углекислого газа.
Гем– комплекс железа (Fe+2) c протопорфирином.
 Биосинтез гема
Биосинтез гема
Наиболее активно гем синтезируется в костном мозге и печени.
В костном мозге гем синтезируется для образования гемоглобина в ретикулоцитах, в печени – гем нужен для синтеза цитохрома P450.
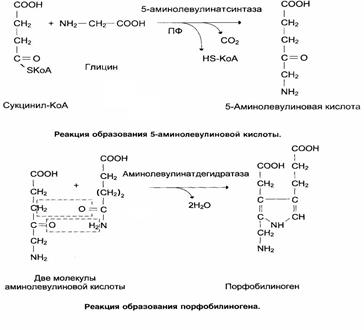
Предшественниками синтеза гема являются глицин и сукцинил-КоА, поэтому путь синтеза гема называется глициносукцинатный цикл.
Первые две реакции приводят к образованию порфобилиногена. Далее идёт образование линейных тетрапирролов, которые завершается синтезом протопорфирина IX. Протопорфирин IX присоединяет Fe2+ с помощью фермента – феррохелатазы (гем-синтезы) и образуется гем.
 Регуляция синтеза гема
Регуляция синтеза гема
Регуляторными ферментами являются АЛК (аминолевулинатсинтетаза) и аминолевулинатдегидрогеназа.
АЛК - синтаза является главным регуляторным ферментом, коферментом которого служит ПФ.
Аллостерическими ингибиторами АЛК-синтетазы служит гем и гемоглобин.
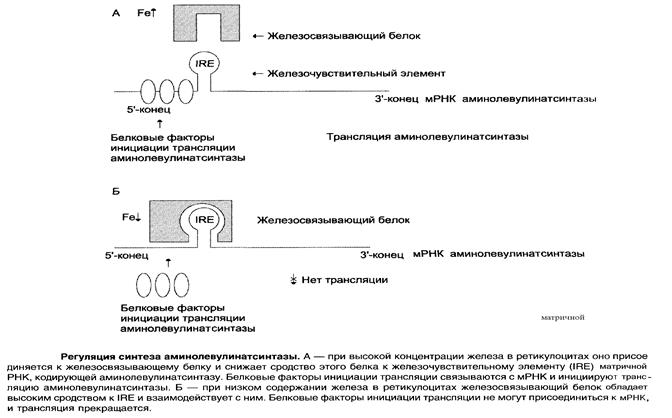
На уровне трансляции АЛК-синтазы регуляция осуществляется концентрацией железа.
В точке инициации мРНК АЛК-синтазы имеется шпилечная петля, которая называется железочувствительный элемент (IRE).
Регуляторный железосвязывающий белок при высокой концентрации железа связывается с железом и вызывает снижение сродства этого белка к IRE – элементу мРНК АЛК-синтетазы и продолжение трансляции.
При низких концентрациях железа увеличивается сродство железосвязывающего белка к IRE-элементу мРНК АЛК-синтетазы и трансляция аминолевупинатсинтетазы тормозится.
Недостаток ПФ и лекарства – аналоги ПФ снижают активность АЛК-синтетазы.
Стероиды, барбитураты, сульфаниламиды, эстрогены – индукторы синтеза АЛК.
 Нарушения синтеза гема – Порфирии
Нарушения синтеза гема – Порфирии
Порфирии – болезни, связанные с нарушением работы ферментов синтеза гема. Первичные порфирии обусловлены генетическими дефектами ферментов синтеза гема, вторичные связаны с нарушениями регуляции синтеза гема.
В зависимости от основной локализации патологического процесса различают печёночные и эритропоэтические наследственные порфирии. При этом эритропоэтические порфирии сопровождаются накоплением порфиринов в нормобластах и эритроцитах, а печёночные – в гепатоцитах.
Порфириногены не окрашены, но на свету они легко переходят в порфирины, которые проявляют красную флуоресценцию в ультрафиолетовых лучах.
В коже на солнце кислород реагирует с порфиринами и переходит в синглетное состояние. В этой форме он вызывает ПОЛ клеточных мембран и разрушение клеток, поэтому порфирии часто сопровождаются фотосенсибилизацией и изъязвлением открытых участков кожи.
Аминолевулинат и порфириногены являются нейротоксинами, что приводит к нейропсихическим расстройствам.
Приём лекарств – индукторов АЛК – синтетазы – сульфаниламидов, барбитуратов, диклофенака, вольтарена, стероидов, истогенов – может вызвать обострение порфирии.
В период полового созревания при повышении образования β-стероидов идёт индукция синтеза АЛК-синтетазы и проявляются симптомы порфирий.
Порфирии наблюдаются и при отравлении солями свинца, т.к. свинец ингибирует АЛК-дегидратазу и феррохелатазу.
Обмен железа
Источником железа для синтеза гема служат пищевые продукты и железо, освобождающееся при распаде эритроцитов.
В гем-содержащих белках железо находится в составе гема.
В негемовых железосодержащих белках железо непосредственно связывается с белком. К таким белкам относят трансферрин, ферритин, рибонуклеотидредуктазу, ксантиноксидазу и др.
В организме взрослого человека содержится 3-4 г. железа.
В пище железо находится в окислённом состоянии (Fe+3). При кислом значении pH желудка железо выделяется из солей органических кислот.
Аскорбиновая кислота (Витамин С), содержащаяся в пище, восстанавливает железо и улучшает его всасывание и в клетки слизистой оболочки кишечника поступает железо в виде Fe+2.
Апоферритин в энтероцитах связывает железо и превращается в ферритин – запасную форму железа.
Железо по крови транспортируется трансферрином.
Трансферрин – гликопротеин, который синтезируется в печени и связывает только окисленное железо (Fe+3).
Поступающее в кровь железо окисляется ферментом феррооксидазой (церулоплазмином). Этом фермент содержит медь.
Трансферрин может соединиться с одним или двумя ионами Fe+3 одновременно с анионом , образуя комплекс трансферрин – 2 (Fe+3 - ).
Трансферрин взаимодействует со специфическими рецепторами клеток. В результате в цитозоле клетки образуется комплекс Ca+2 – кальмодулин – ПКС, который фосфорилирует рецептор трансферрина и вызывает образование эндосомы.
В эндосоме создаётся кислая среда при действии АТФ – зависимого протонного насоса. При этом железо освобождается из трансферрина.
Ферритин – олигомерный белок, состоит из 24 протолиров и служит для запасания железа в клетке. В разных тканях существуют его изоформы.
Ферритин имеет полость, внутри которой может содержаться до 4500 ионов Fe+3.
Fe+2 окисляют в Fe+3 тяжёлые цепи ферритина. Комплекс железа в виде гидрофосфата хранится внутри сферы, образованной белковой частью молекулы.
Наибольшая часть ферритина содержится в печени, селезёнке и костном мозге.
