Особенности переваривания углеводов в детском возрасте
-Снижена активность амилазы слюны (до 4 лет)
-Преобладает пристеночное переваривание углеводов в тонком кишечнике
-Выше активность лактазы,
-Повышение активности сахаразы с введением прикорма
-Снижена активность амилазы поджелудочной железы
2. Катаболизм аминокислот. Общие пути распада аминокислот. Трансаминирование аминокислот. Схема реакций, ферменты, роль витамина В6 Биологическое значение трансаминирования. Диагностическое значение определения трансаминаз в сыворотке крови.
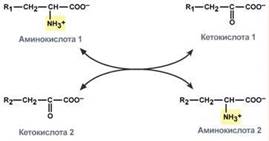 Непрямое окислительное дезаминирование (трансдезаминирование).Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
Непрямое окислительное дезаминирование (трансдезаминирование).Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
Первый этап заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты – этот перенос называется трансаминирование и его механизм довольно сложен. В качестве кетокислоты-акцептора ("кетокислота 2") в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат ("аминокислота 2"). В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О. При необходимости (например, голодание) углеродный скелет глюкогенных аминокислот может использоваться для синтеза глюкозы в глюконеогенезе.
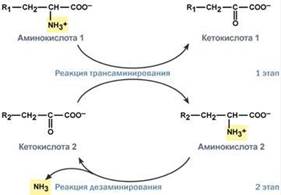 Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование. В организме человека дезаминированию подвергается только глутаминовая кислота. Второй этап осуществляется глутаматдегидрогеназой (перейти вверх). В организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, и только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма, кроме мышечных. Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование. Если реакция идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза. Т.к. НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН. Роль трансаминирования и трансдезаминирования:
Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование. В организме человека дезаминированию подвергается только глутаминовая кислота. Второй этап осуществляется глутаматдегидрогеназой (перейти вверх). В организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, и только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма, кроме мышечных. Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование. Если реакция идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза. Т.к. НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН. Роль трансаминирования и трансдезаминирования:
Реакции трансаминирования:
-активируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот – с целью оптимизации их соотношения,
-обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога),
-начинаются при прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) – с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии,
-необходимы при внутриклеточном голодании, например, при гипогликемиях различного генеза – для использования безазотистого остатка аминокислот в печени для кетогенеза и глюконеогенеза, в других органах – для его прямого вовлечения в реакции цикла трикарбоновых кислот.
-при патологиях (сахарный диабет, гиперкортицизм) обуславливают наличие субстратов для -глюконеогенеза и способствуют патологической гипергликемии.
Продукт трансаминирования глутаминовая кислота:
-является одной из транспортных форм аминного азота в гепатоциты,
-способна реагировать со свободным аммиаком, обезвреживая его.
 Процесс трансдезаминирования идет в организме непрерывно, потому что сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей.
Процесс трансдезаминирования идет в организме непрерывно, потому что сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей.
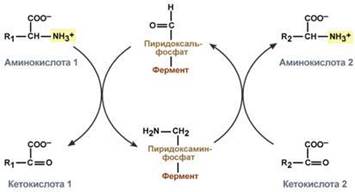
Механизм реакции трансаминирования непрост и протекает по типу "пинг-понг". Катализируют реакцию ферменты аминотрансферазы, Они являются сложными ферментами, в качестве кофермента имеют пиридоксальфосфат (активная форма витамина В6). В тканях насчитывают около 10 аминотрансфераз, обладающие групповой специфичностью и вовлекающие в реакции все аминокислоты, кроме пролина, лизина, треонина, которые не подвергаются трансаминированию.
Весь перенос аминогруппы совершается в две стадии:
1.к пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат.
2. на второй стадии к пиридоксаминфосфату присоединяется другая кетокислота, получает аминогруппу, образуется новая аминокислота и пиридоксальфосфат регенерирует.
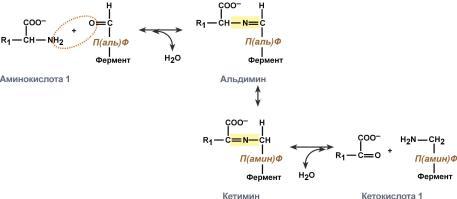 Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется водой по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.
Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется водой по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.
После отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: образуется кетимин, затем альдимин, после чего отделяется новая аминокислота. Чаще всего аминокислоты взаимодействуют со следующими кетокислотами: пировиноградной с образованием аланина, щавелевоуксусной с образованием аспартата, α-кетоглутаровой с образованием глутамата. Однако аланин и аспартат в дальнейшем все равно передают свою аминогруппу на α-кетоглутаровую кислоту. Таким образом, в тканях осуществляется поток избыточных аминогрупп на один общий акцептор – α-кетоглутаровую кислоту. В итоге образуется большое количество глутаминовой кислоты. Далее глутаминовая кислота может вовлекается в процессы  связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование.
связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование.
В медицине нашло практическое применение определение активности двух ферментов трансаминирования – аланинаминотрансферазы (АЛТ, АлАТ) и аспартатаминтрансферазы (АСТ).
Оба фермента обратимо взаимодействуют с α-кетоглутаровой кислотой и переносят на нее аминогруппы от соответствующих аминокислот с образованием глутаминовой кислоты и кетокислот. Хотя активность обоих ферментов значительно возрастает при заболеваниях сердечной мышцы и печени, при поражении клеток миокарда наибольшая активность в сыворотке крови обнаруживается для АСТ, при гепатитах – для АЛТ.
3. Особенности синтеза и процессинга секретируемых белков (на примере коллагена и инсулина).
Схема биосинтеза инсулина в β-клетках островков Лангерханса. ЭР - эндоплазматический ретикулум. 1 - образование сигнального пептида; 2 - синтез препроинсулина; 3 - отщепление сигнального пептида; 4 - транспорт проинсулина в аппарат Гольджи; 5 - превращение проинсулина в инсулин и С-пептид и включение инсулина и С-пептида в секреторные гранулы; 6 - секреция инсулина и С-пептида. 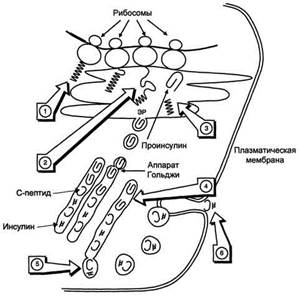
Биосинтез инсулинавключает образование двух неактивных предшественников, препроинсулина и проинсулина, которые в результате последовательного протеолиза превращаются в активный гормон. Биосинтез препроинсулина начинается с образования сигнального пептида на полирибосомах, связанных с ЭР. Сигнальный пептид проникает в просвет ЭР и направляет поступление в просвет ЭР растущей полипептидной цепи. После окончания синтеза препроинсулина сигнальный пептид, включающий 24 аминокислотных остатка, отщепляется.
Проинсулин (86 аминокислотных остатков) поступает в аппарат Гольджи, где под действием специфических протеаз расщепляется в нескольких участках с образованием инсулина (51 аминокислотный остаток) и С-пептида, состоящего из 31 аминокислотного остатка.
Инсулин и С-пептид в эквимолярных количествах включаются в секреторные гранулы. В гранулах инсулин соединяется с цинком, образуя димеры и гексамеры. Зрелые гранулы сливаются с плазматической мембраной, и инсулин и С-пептид секретируются во внеклеточную жидкость в результате экзоцитоза. После секреции в кровь олигомеры инсулина распадаются. Т1/2 инсулина в плазме крови составляет 3-10 мин, С-пептида - около 30 мин.
Разрушение инсулина происходит под действием фермента инсулиназы в основном в печени и в меньшей степени в почках.
Синтез и созревание коллагена - сложный многоэтапный процесс, начинающийся в клетке, а завершающийся в межклеточном матриксе. Синтез и созревание коллагена включают в себя целый ряд посттрансляционных изменений:
гидроксилирование пролина и лизина с образованием гидроксипролина (Hyp) и гидроксилизина (Hyl);
гликозилирование гидроксилизина;
частичный протеолиз - отщепление "сигнального" пептида, а также N- и С-концевых пропептидов;
образование тройной спирали.
Синтез коллагена регулируется разными способами. Прежде всего, сам коллаген и N-npo-пептиды после своего отщепления тормозят трансляцию коллагена по принципу отрицательной обратной связи. Аскорбиновая кислота стимулирует синтез коллагена и протеогликанов, а также пролиферацию фибробластов.
Особую роль в регуляции синтеза коллагена играют гормоны. Глюкокортикоиды тормозят синтез коллагена, во-первых, путём снижения уровня мРНК проколлагена, а во-вторых - ингибированием активности ферментов пролилилизилгидроксилазы. Недостаточное гидроксилирование остатков пролина и лизина повышает чувствительность коллагена к действию коллагеназы и неспецифических протеаз. Макроскопически угнетающее действие глюкокортикоидов на синтез коллагена проявляется уменьшением толщины дермы, а также атрофией кожи в местах продолжительного парентерального введения этих гормонов.
На синтез коллагена влияют также половые гормоны, рецепторы к которым обнаружены не только в строме половых органов, но и в фиб-робластах других органов и тканей. Обмен коллагена в матке находится под контролем половых гормонов. Синтез коллагена кожи зависит от содержания эстрогенов, что подтверждает тот факт, что у женщин в менопаузе снижается содержание коллагена в дерме.
Б.5
1. Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования (на примере ферментов синтеза и распада гликогена).
В биологических системах часто встречается механизм регуляции активности ферментов с помощью ковалентной модификации аминокислотных остатков. Быстрый и широко распространённый способ химической модификации ферментов - фосфорилирование/дефосфорилирование. Модификации подвергаются ОН-группы фермента. Фос-форилирование осуществляется ферментами протеинкиназами, а дефосфорилирование - фосфопротеинфосфатазами. Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными.
Изменение активности фермента, вызванное фосфорилированием, обратимо. Отщепление остатка фосфорной кислоты осуществляется ферментами фосфопротеинфосфатазами. Активность протеинкиназ и фосфопротеинфосфатаз регулируется гормонами, что позволяет быстро изменять активность ключевых ферментов метаболических путей в зависимости от условий внешней среды. Антагонистичные по функции гормоны противоположным образом влияют на фосфо-рилирование/дефосфорилирование ферментов, вызывая противоположные эффекты изменения метаболизма клетки.
Например, под действием глюкагона (в период между приёмами пищи) в клетках происходит уменьшение синтеза энергетического материала - жира, гликогена и усиление его распада (мобилизация), вызванного фосфо-рилированием ключевых ферментов этих процессов. А под действием инсулина (во время пищеварения), наоборот, активируется синтез гликогена и ингибируется его распад, так как взаимодействие инсулина с рецептором активирует сигнальный путь, приводящий к дефосфорилированию тех же ключевых ферментов. 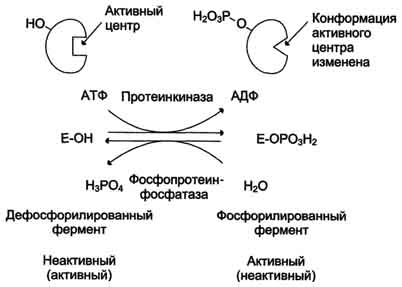
2. Цикл лимонной кислоты, схема процесса. Связь цикла с цепью переноса электронов и протонов. Регуляция цикла лимонной кислоты. Анаболические и анаплеротические функции цитратного цикла.
Связь окислительного декарбоксилирования
пирувата с ЦПЭ
Окислительное декарбоксилирование пирувата сопровождается образованием NADH, поставляющим электроны в дыхательную цепь и обеспечивающим синтез 3 молей АТФ на 1 моль пирувата путём окислительного фосфорилирования.
Так как отношения ДДФ/АТФ и NADH/NAD+ в клетке относительно постоянны, ускорение утилизации АТФ приводит к повышению концентрации АДФ и ускорению окисления NADH в дыхательной цепи. Повышение концентрации NAD+, в свою очередь, стимулирует окислительное декарбоксилирование пирувата. Напротив, повышение концентрации АТФ и NADH снижает скорость этого процесса. Таким образом, изменения отношений АДФ/АТФ и NADH/ NAD+ - важнейшие сигналы, отражающие энергетические потребности клетки и регулирующие скорость окислительного декарбоксилирования пирувата. Каталитическая активность пируват-дегидрогеназного комплекса снижается, когда в клетках имеется достаточно "топлива" в виде жирных кислот и ацетил-КоА.
В. Анаболические функции цитратного цикла
Цикл лимонной кислоты - один из амфиболических путей метаболизма. В нём осуществляются не только окислительные превращения энергетических субстратов до конечных продуктов
СО2 и Н2О, но и происходит образование субстратов для других метаболических путей (рис. 6-28).
Некоторые промежуточные продукты цикла лимонной кислоты: α-кетоглутарат, сукцинат, оксалоацетат могут использоваться для синтеза заменимых аминокислот (см. раздел 9).
Убыль промежуточных продуктов цикла восполняется в реакциях, катализируемых специфическими ферментами. В нормальных условиях реакции, отвлекающие промежуточные продукты из цикла и восполняющие их убыль, находятся в состоянии динамического равновесия, так что концентрация этих продуктов в митохондриях остаётся постоянной.
Реакции, обеспечивающие пополнение фонда промежуточных продуктов ЦТК, называются анаплеротическими (пополняющими). Важнейшая из них - реакция синтеза оксалоацетата из пирувата. Эту реакцию катализирует митохондриальный фермент - пируваткарбоксилаза.
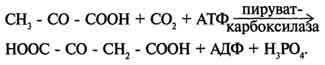
Пируваткарбоксилаза - сложный олигомерный фермент. Молекула фермента содержит 4 простетические группы, представленные биотином (см. раздел 3), который ковалентно связан амидной связью с е-аминогруппами остатков лизина, находящегося в активном центре фермента (рис. 6-29).
Если для цикла лимонной кислоты не хватает оксалоацетата или какого-нибудь другого промежуточного продукта, то карбоксилирование пирувата ускоряется. В этой реакции в качестве источника энергии используется АТФ.
Реакция протекает в 2 стадии. На первой стадии происходит активация СО2 путём присоединения к одному из атомов азота в молекуле биотина. Эта реакция сопряжена с гидролизом АТФ.
АТФ + СО2+ Е-биотин + Н2О → АДФ + Н3РО4 + Е-биотин-СОО- + 2 Н+.
На второй стадии активированная карбоксильная группа переносится на пируват.
Е-биотин-СОО" + Пируват -" Е-биотин + Оксалоацетат.
Пируваткарбоксилаза - регуляторный фермент. Если концентрация ацетил-КоА увеличивается, то он действует как аллостерический активатор пируваткарбоксилазы, ускоряя образование оксалоацетата. Таким образом, избыток ацетил-КоА способствует активации цитратного цикла.
Метаболиты цитратного цикла используются не только как субстраты синтеза углеродного скелета ряда соединений, но и являются донорами водорода для образования восстановленных коферментов, участвующих в реакциях синтеза жирных кислот, стероидов и других веществ (см. разделы 8, 10, 11). Два метаболита нитратного цикла могут дегидрироваться при участии NADP-зависимых дегидрогеназ: малата и изоцитрата. Например, малат может поступать из митохондрий в цитозоль клетки. В цитозоле находится NADP-зависимая дегидрогеназа (малик-фермент), катализирующая реакцию:
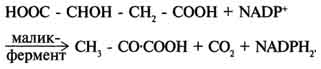
Малат и изоцитрат обеспечивают образование около половины общего фонда NADPH, используемого в восстановительных синтезах; вторая половина образуется в пентозофосфатном пути превращения глюкозы.
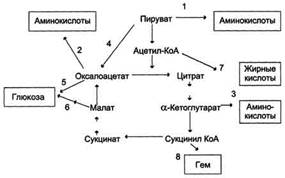
3. Биохимия питания. Основные компоненты пищи человека, их биороль, суточная потребность в них. Незаменимые компоненты пищи.
Полноценное питание должно содержать:
-источники энергии (углеводы, жиры, белки);
-незаменимые аминокислоты;
-незаменимые жирные кислоты;
-витамины;
-неорганические (минеральные) кислоты);
-клетчатку;
-Н2О.Установлено, что при умеренной физической нагрузке в течение одного часа, потери воды составляют 1,5-2 л при температуре 20-25 градусов. Следовательно, восполнение жидкости после нагрузки является важным средством восстановления.
Углеводы, жиры и белки являются макропитательными веществами. Их потребление зависит от роста, возраста и пола человека и определяется в граммах. Минимальное потребление углеводов составляет 50-100 г.
Углеводы составляют основной источник энергии в питании человека - самая дешевая пища. В развитых странах около 40 % потребления углеводов приходится на рафинированные сахара, а 60 % составляет крахмал. В менее развитых странах доля крахмала возрастает. За счет углеводов образуется основная часть энергии в организме человека.
Жиры - это один из основных источников энергии. Перевариваются в желудочно-кишечном тракте (ЖКТ) гораздо медленнее, чем углеводы, поэтому лучше способствуют возникновению чувства сытости. Триглицериды растительного происхождения являются не только источником энергии, но и незаменимымых жирных кислот: линолевой и линоленовой.Не рекомендуем употреблять больше 80-100 г и меньше 25-30 г жира в сутки, так как при пониженном содержании жира в рационе пострадают наша кожа и волосы, снизится сопротивляемость инфекциям и нарушится обмен витаминов A., D, Е, К.
Белки- энергетическая функция не является для них основной. Белки - это исочники незаменимых и заменимых аминокислот, а также предшественники биологически активных веществ в организме. Однако при окислении аминокислот образуется энергия. Хотя она и невелика, но составляет некоторую часть энергетического рациона. Потребность организма взрослого человека, ведущего активный образ жизни составляет 1,6— 2,2 г на 1 кг массы тела.
Минеральные вещества.
За один прием пищи организм может усваивать до 30-50 г белка, поэтому суточное количество белка лучше распределять равномерно на 4-6 приемов пищи, так как меньшие количества продукта лучше усваиваются и более эффективно используются организмом.
Макроэлементы содержатся в организме в больших количествах, суточная потребность в них колеблется от 0,4 до 5-7 г. Макроэлементы входят в состав тканей, мышц, костей, крови; обеспечивают солевой и ионный баланс жидкостей организма. К ним относятся кальций, фосфор, магний, натрий, калий, хлор и сера.
Микроэлементы — это вещества, содержание которых в организме составляет 1 мг на 1 кг массы тела и меньше, суточная потребность составляет 10-20 мг. Микроэлементы входят в состав гемоглобина, витамина В12, гормонов и ферментов. 14 микроэлементов признаны жизненно необходимыми нашему организму: железо, медь, марганец, цинк, кобальт, род, фтор, хром, молибден, ваннадий, никель, олово, кремний, селен.
