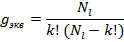Особенности спектральных термов в приближении “L-S” связи.
В приближении центрального поля энергия атома полностью определяется заданием электронной конфигурации, т.е. заданием n l для каждого электрона.
Каждой электронной конфигурации ( 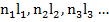 ) соответствует
) соответствует 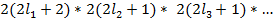 состояний. Все эти состояния различаются значениями
состояний. Все эти состояния различаются значениями 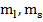 . Отнесение этих состояний к одному и тому же энергетическому уровню возможно до тех пор, пока мы не учитываем спин-орбитальное или электростатическое взаимодействие. Учет этих взаимодействий приводит к расщеплению уровней на ряд подуровней. Электростатическое взаимодействие приводит к расщеплению уровня, соответствующего данной электронной конфигурации на ряд подуровней, характеризуемых различными значениями полного орбитального момента электронов и спина.
. Отнесение этих состояний к одному и тому же энергетическому уровню возможно до тех пор, пока мы не учитываем спин-орбитальное или электростатическое взаимодействие. Учет этих взаимодействий приводит к расщеплению уровней на ряд подуровней. Электростатическое взаимодействие приводит к расщеплению уровня, соответствующего данной электронной конфигурации на ряд подуровней, характеризуемых различными значениями полного орбитального момента электронов и спина.
Физический смысл зависимости энергии расщепления от L
Различным значениям L соответствует различная ориентация орбитальных моментов отдельных электронов.
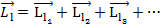
В состояниях с различными значениями L электроны находятся на разных расстояниях друг от друга, поэтому различной будет энергия электростатического отталкивания. Энергия взаимодействия электронов с ядром и энергия взаимодействия электронов друг с другом имеют разные знаки, поэтому электростатическое взаимодействие приводит к сдвигу энергетических уровней вверх ( Значение энергии по абсолютной величине уменьшается).
Эмпирически было установлено, что для основных конфигураций и для конфигураций, содержащих эквивалентные электроны, расщепление уровней при электростатическом взаимодействии подчиняется правилу Хунда, которое гласит, что:
наименьшей энергией обладает уровень с наибольшим возможным для данной электронной конфигурации значением квантового числа полного спинового момента S и наибольшим возможным для данного S значением орбитального квантового числа L.
Состояние с наименьшей энергией в атоме называется основным.
Уровни энергии, соответствующие определенным значениям L и S, называются спектральными термами.
Для обозначения термов используют заглавные буквы латинского алфавита.
Если 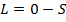 ,
, 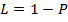 ,
, 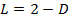 . И.т.д.
. И.т.д.
Релятивистские эффекты, в частности спин-орбитальное взаимодействие, приводят к расщеплению каждого терма на ряд компонент, соответствующих значениям полного механического момента атома.
Полный механический момент - 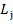 , где j – квантовое число полного механического момента.
, где j – квантовое число полного механического момента.
Расщепление терма в результате спин-орбитального взаимодействия называется тонким или мультиплетным.
Квантовое число полного момента может принимать значения: 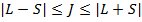 ;
; 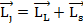
Если L>S => всего (2S+1) значение J => каждый терм расщепляется на (2S+1) компоненту.
Если L<S=> всего (2L+1) значение J => каждый терм расщепляется на (2L+1) компоненту.
Мультиплетность: 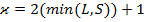 .
.
Полное обозначение терма: 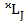 .
.
В зависимости от того, на сколько компонент расщепляется терм при спин-орбитальном взаимодействии, термы подразделяют на синглетные, дуплетные и триплетные.
Каждому терму с L и S относится (2L+1)(2S+1) состояний, отличающихся значением квантовых чисел проекций орбитального и спинового моментов, поэтому состояние многоэлектронного атома будет вырождено.
Энергия изолированного атома не может зависеть от того, как полный механический момент атома ориентирован в пространстве, следовательно, каждая j-тая компонента терма вырождена с кратностью вырождения 2J+1 и статистический вес состояния равен:
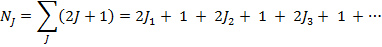
C другой стороны:
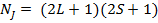 , т.е. учёт спин-орбитального взаимодействия не меняет числа состояний, относящихся к терму LS
, т.е. учёт спин-орбитального взаимодействия не меняет числа состояний, относящихся к терму LS
Мультиплетное расщепление подчиняется правилу интервалов Ланде, которое гласит:
1) расщепление уровней с квантовыми числами J, J-1 пропорционально J
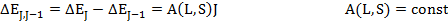
2) A(L,S) – постоянная мультиплетного расщепления. Зависит от квантовых чисел L и S и может быть как положительной, так и отрицательной.
· Если при A>0, наименьшим значением энергии обладает с наименьшим большим возможным значением J=L-S , то такие мультиплеты называются нормальными.
· Если при A<0 наименьшим значением энергии обладает компонента мультиплета с наибольшим возможным значением J=L+S, то такие мультиплеты называются обращенными.
Эмпирически было установлено, что для конфигурации атомов, содержащих n эквивалентных электронов, справедлива закономерность:
· если n<(2l+1), т.е. оболочка заполнена менее чем на половину, то для такого атома будет наблюдаться нормальный мультиплет
· если n>(2l+1), т.е. оболочка заполнена более чем на половину, то для такого атома будет наблюдаться обращенный мультиплет
· если n=(2l+1), мультиплетное расщепление отсутствует
Группировка уровней, типичная для L-S связи:
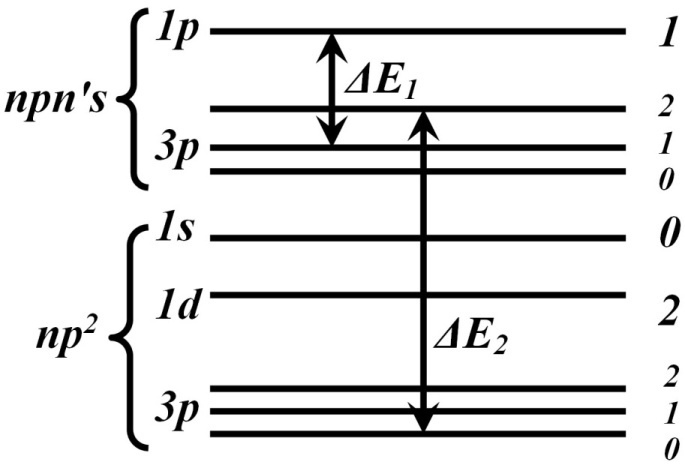
Расстояние между термами одной электронной конфигурации значительно меньше, чем расстояние между одинаковыми термами различных конфигураций: 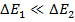
Каждый терм, за исключением синглетных и S-термов, имеет тонкую структуру, причем расстояние между компонентами этой структуры значительно меньше, чем расстояние между различными термами.
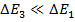
L-S связь называется связью Рассела-Саундерса, или нормальной связью.
Нахождение термов многоэлектронной конфигурации, состоящей из неэквивалентных электронов:
Все возможные термы легко получить на основании общего квантовомеханического правила сложения моментов.
1) Находим орбитальный механический момент системы: 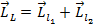 ,
, 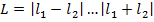
2) Находим спиновой механический момент системы: 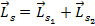 ,
, 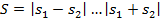
3) 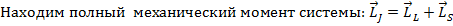 ,
, 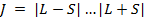
Состояние записываем в виде:
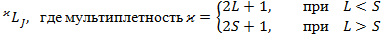
Сложение производится сначала для двух электронов, а затем к получившимся термам последовательно присоединяются по одному электрону.
Пример Найти всевозможные термы для конфигурации npn’p’, а затемдля конфигурацииnpn’p’n’’p’’
Добавление 1 электрона к синглетным термам даёт дублетные термы, к дублетным – синглетные и триплетные, к триплетным – дублетные и квартетные.
Существует простой приём определить мультиплетность термов, состоящих из неэквивалентных электронов: добавляя к терму данной конфигурации электрон, мы получим термы с мультиплетностью на единицу больше и единицу меньше исходной.
Часто указывается статистический вес конфигурации. Статистическим весом конфигурации называется полное число состояний, относящихся к данной электронной конфигурации. Для конфигурации, содержащей неэквивалентные электроны:
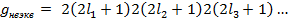
Для конфигураций из k эквивалентных электронов статистический вес определяется числом возможных комбинаций, которые можно составить из квантовых чисел 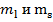 с учетом принципа Паули. Число таких комбинаций равно числу сочетаний из
с учетом принципа Паули. Число таких комбинаций равно числу сочетаний из 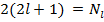 по k:
по k: