Прохождение электрического тока в электрохимической системе.
Законы Фарадея
Если замкнуть электрохимическую систему проводником первого рода или подключить ее к внешнему источнику тока, то через нее начнет проходить электрический ток. На границах изменения типа электрической проводимости происходят химические превращения веществ. Так как каждый элементарный акт электрохимической реакции сопровождается выделением или присоединением одного или нескольких электронов, то естественно, что чем большее число электронов пройдет через границу раздела проводник первого рода- проводник второго рода, тем больше будет прореагировавшая масса веществ - участников реакции.
Поскольку число прошедших через границу раздела электронов есть количество электричества, то изложенные выше соображения приводят к двум фундаментальным законам, открытым в 1833-1834 годах Фарадеем. Первый закон Фарадея может быть сформулирован так:
Если на границе раздела проводник первого рода - проводник второго рода при прохождении постоянного электрического тока протекает одна электрохимическая реакция, то масса каждого из участников реакции, претерпевших превращение, прямо пропорциональна количеству прошедшего через границу электричества.
Первый закон Фарадея, таким образом, можно представить уравнением
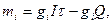 (33.37)
(33.37)
где 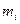 масса
масса 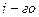 вещества, претерпевшего превращение;
вещества, претерпевшего превращение; 
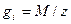 - фактор пропорциональности, называемый электрохимическим эквивалентом и показывающий, какое количество вещества претерпело превращение при прохождении через границу единицы количества электричества; I-постоянный ток, проходящий через границу раздела;
- фактор пропорциональности, называемый электрохимическим эквивалентом и показывающий, какое количество вещества претерпело превращение при прохождении через границу единицы количества электричества; I-постоянный ток, проходящий через границу раздела; 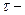 продолжительность прохождения тока;
продолжительность прохождения тока; 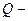 количество прошедшего электричества;
количество прошедшего электричества; 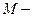 молекулярный вес металла; z- число электронов участвующих в реакции.
молекулярный вес металла; z- число электронов участвующих в реакции.
Электрический ток, проходящий через границу раздела и вызывающий электрохимическое превращение, называется фарадеевским током. В зависимости, от того, в каких единицах выражены 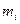 и
и 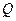 электрохимический эквивалент имеет разные значения и единицы измерения. Если
электрохимический эквивалент имеет разные значения и единицы измерения. Если 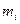 выражена в граммах или молях, а
выражена в граммах или молях, а 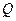 - в кулонах, то электрохимический эквивалент - в граммах на кулон или молях на кулон. В прикладной электрохимии единицей количества электричества обычно является ампер-час, равный 3600 Кл. Тогда
- в кулонах, то электрохимический эквивалент - в граммах на кулон или молях на кулон. В прикладной электрохимии единицей количества электричества обычно является ампер-час, равный 3600 Кл. Тогда 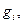 будет выражено в граммах на ампер-час или молях на ампер-час.
будет выражено в граммах на ампер-час или молях на ампер-час.
Число молекул или ионов в одном моле вещества равно числу Авогадро 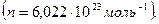 Если каждая молекула или ион в электрохимической реакции вступает во взаимодействие с z электронами, то превращение одного моля вещества будет связано с затратой или освобождением zen количества электричества (где е— заряд электрона). Соответственно превращение, вызванное одним молем электронов, будет: zen/z=F=en. Величина F одна и та же для всех реакций и называется константой Фарадея . Численно она равна:
Если каждая молекула или ион в электрохимической реакции вступает во взаимодействие с z электронами, то превращение одного моля вещества будет связано с затратой или освобождением zen количества электричества (где е— заряд электрона). Соответственно превращение, вызванное одним молем электронов, будет: zen/z=F=en. Величина F одна и та же для всех реакций и называется константой Фарадея . Численно она равна:
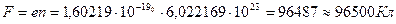 на моль электронов.
на моль электронов.
Первый закон Фарадея, базирующийся на атомистической природе вещества и электричества, является точным законом природы. Отклонений от него нет. Если на электроде протекает несколько параллельных электрохимических реакций, то первый закон Фарадея будет справедлив для каждой из них (с учетом всех возможных побочных химических реакций, сопутствующих данной электрохимической реакции).
Для практических целей введено понятие выхода по току 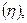 т. е доли тока, приходящейся на данное вещество. Следовательно, если на электроде протекает только одна электрохимическая реакция и нет побочных процессов, то выход по току
т. е доли тока, приходящейся на данное вещество. Следовательно, если на электроде протекает только одна электрохимическая реакция и нет побочных процессов, то выход по току 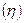 равен единице (или 100%). Если же на электроде протекают несколько параллельных реакций и имеются побочные процессы, то выход по току
равен единице (или 100%). Если же на электроде протекают несколько параллельных реакций и имеются побочные процессы, то выход по току 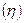 меньше единицы и количественно определяется из выражений
меньше единицы и количественно определяется из выражений
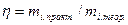 или
или 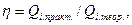 (33.38)
(33.38)
где 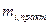 - масса i-го вещества, практически превратившегося в результате прохождения
- масса i-го вещества, практически превратившегося в результате прохождения 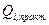 - количества электричества необходимое для превращения той же единицы i-го вещества;
- количества электричества необходимое для превращения той же единицы i-го вещества; 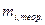 - масса i-го вещества, которая должна превратиться теоретически при прохождении
- масса i-го вещества, которая должна превратиться теоретически при прохождении 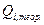 по закону Фарадея для превращения единицы i-го вещества, для которого рассчитывается выход по току. Выходы по току для процессов, протекающих на катоде, как правило, не совпадают с выходами по току анодных процессов, поэтому введено понятие катодного
по закону Фарадея для превращения единицы i-го вещества, для которого рассчитывается выход по току. Выходы по току для процессов, протекающих на катоде, как правило, не совпадают с выходами по току анодных процессов, поэтому введено понятие катодного 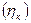 и анодного
и анодного 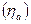 выходов по току.
выходов по току.
Второй закон Фарадея является непосредственным следствием первого закона. Согласно второму закону Фарадея:
Если на границе раздела проводник первого рода - проводник второго рода протекает одна, и только одна, электрохимическая реакция, в которой участвует несколько веществ, то массы участников реакции, претерпевших превращения, относятся друг к другу как их химические эквиваленты.
Электрохимические системы, в которых нет параллельных электрохимических и побочных химических реакций, и следовательно 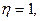 используют для измерения количества прошедшего электричества. Они называются кулоно-метрами (кулометрами) или вольтамперометрами. Наиболее точные результаты получают при использовании системы с серебряными или медными электродами.
используют для измерения количества прошедшего электричества. Они называются кулоно-метрами (кулометрами) или вольтамперометрами. Наиболее точные результаты получают при использовании системы с серебряными или медными электродами.
[1] Электрической проводимостью при бесконечном разбавлении, т.е. при бесконечно малой концентрации, и обозначают как
[2] Части сосуда могут быть разделены не диафрагмой, а сплошной перегородкой, и сообщаться друг с другом через электролитический мостик. Мембрана или электролитический мостик обеспечивают электрическую проводимость между растворами, но препятствуют их смешению.
[3] Понятию электрохимическая система эквивалентны часто встречающиеся в литературе названия гальванический элемент, электрохимическая ячейка, цепь.
