Двойной электрический слой. Равновесный электродный потенциал. Уравнение Нернста
Избыточный заряд не распределяется равномерно в объеме твердой или жидкой фазы. Например, избыточные электроны в цинковой пластине под
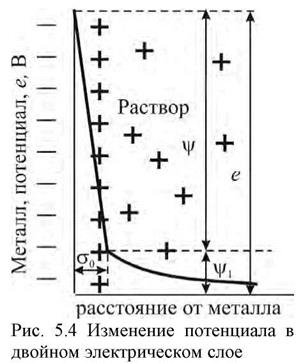 | влиянием электростатического притяжения положительно заряженных ионов в растворе сосредоточены вблизи поверхности электрода, а катионы 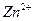 скапливаются у поверхности электрода (рис. 4), образуя плотную часть двойного электрического слоя а0, за пределами которого существует диффузная часть двойного электрического слоя, образующаяся вследствие теплового движения частиц. В результате между металлом и раствором, как между обкладками конденсатора, возникает скачок потенциала е, складывающийся из скачка в линейной скапливаются у поверхности электрода (рис. 4), образуя плотную часть двойного электрического слоя а0, за пределами которого существует диффузная часть двойного электрического слоя, образующаяся вследствие теплового движения частиц. В результате между металлом и раствором, как между обкладками конденсатора, возникает скачок потенциала е, складывающийся из скачка в линейной |
плотного слоя 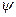 и нелинейной в диффузной -
и нелинейной в диффузной - 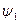
Равновесный электродный потенциал (e) численно равен разности внутренних потенциалов фаз 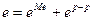 . Величину равновесного электродного потенциала можно найти из условия равенства химических потенциалов раствора
. Величину равновесного электродного потенциала можно найти из условия равенства химических потенциалов раствора 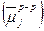 и металла
и металла 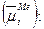

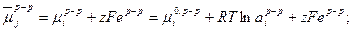
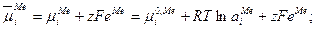
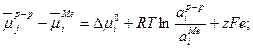
Откуда 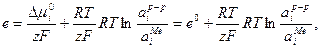 (33.18)
(33.18)
где 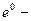 стандартный электродный потенциал, равновесный потенциал металлического электрода при стандартных температуре и давлении м при активности ионов металла в растворе равной единице. Активность чистых металлов принимается равной единице. Уравнение (33.18) получено для случая, когда в системе протекает электрохимическая реакция
стандартный электродный потенциал, равновесный потенциал металлического электрода при стандартных температуре и давлении м при активности ионов металла в растворе равной единице. Активность чистых металлов принимается равной единице. Уравнение (33.18) получено для случая, когда в системе протекает электрохимическая реакция 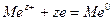 В общем случае уравнение для равновесного электродного потенциала (e) имеет вид
В общем случае уравнение для равновесного электродного потенциала (e) имеет вид
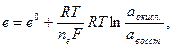 (33.19)
(33.19)
где 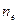 - число электронов принимающих участие в электродной реакции;
- число электронов принимающих участие в электродной реакции; 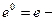 при условии равенства активностей окисленной и восстановленной форм
при условии равенства активностей окисленной и восстановленной форм 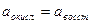 .
.
Уравнение (33.19) называется уравнением Нернста. Если подставить в него численные значения универсальной газовой постоянной, то для Т = 298 К получим
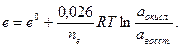
Стандартный электродный потенциал
Стандартный электродный потенциал отвечает потенциалу обратимого электрода в тех случаях, когда отношения активностей под логарифмом равно единице. Абсолютную величину потенциала каждого отдельного электрода невозможно. Поэтому принято, что потенциал водородного электрода при активности водородных ионов в растворе, равной единице, и давлении водорода, равном 1 атм. имеет потенциал равен нулю и к нему относят значения потенциалов всех других электродов. Эта условная шкала потенциалов называется водородной шкалой.
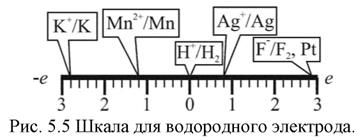
Пример применения этой шкалы для ряда электродов приведен на рис. 5 Значения некоторых электродов по водородной шкале приведены в приложении.
Классификация электродов
В основу классификации электродов положены свойства веществ, участвующие в потенциал-определяющих процессах. Принято различать электроды первого рода, второго рода, газовые, окислительно-восстановительные и др. расчет потециалов, которых производится по Уравнению Нернста (33.19).a
Электроды первого рода - это электроды, в которых твердой фазой является металл или металлоид. Потенциал электрода первого рода зависит от активности лишь одного определенного сорта ионов. В случае металлических электродов первого рода такими ионами будут катионы металла 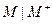 а в случае металлоидных - анионы металлоида (и электроды называют, оответственно обратимыми относительно катиона или аниона).
а в случае металлоидных - анионы металлоида (и электроды называют, оответственно обратимыми относительно катиона или аниона).
Электродную реакцию записывают соответственно как
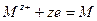
Тогда выражение для электродного потенциала для электрода первого рода будет:
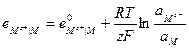 (33.20)
(33.20)
Если учесть, что активность чистого твердого вещества при заданной температуре постоянна и принять ее условно равной единице, то:
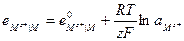
Например, серебряный электрод первого рода записывается в виде 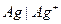 Ему отвечает реакция
Ему отвечает реакция
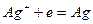
и его электродный потенциал
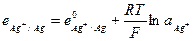
Примером металлоидных электродов первого рода может служить селеновый электрод 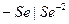 на котором протекает реакция
на котором протекает реакция
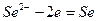
и его электродный потенциал
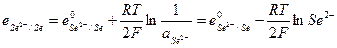
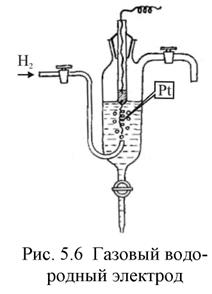
Газовые электроды, выделены в особую группу электродов, более сложную в конструктивном оформлении.
Газовый электрод представляет собой полуэлемент, состоящий из металлического проводника, контактирующего одновременно с соответствующим газом и с раствором, содержащим ионы этого газа. Газовый электрод невозможен без участия металлического проводника. Металл газового электрода должен быть инертным и поэтому чаще всего используют платину или углерод. В качестве примера на рис. 5 схематически изображена конструкция водородного электрода. Водородные электроды используют в качестве стандартных: принято, что при всех температурах и при парциальном давлении водорода равном 1 атм, 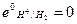
Газовый водородный электродможно представить схемой 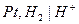 . Ему отвечает электродная реакция:
. Ему отвечает электродная реакция:
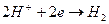
и его электродный потенциал
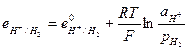
 (33.21)
(33.21)
 | Из выражения (33.21) видно, что потенциал водородного электрода определяется не только активностью водородных ионов, но и парциальным давлением водорода. Согласно определению условной шкалы электродных потенциалов, стандартный потенциал водородного электрода всех температурах принят равным нулю и при парциальном давлении водорода равном 1 атм, и учитывая, что 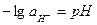 уравнение (33.21) упрощается: уравнение (33.21) упрощается: 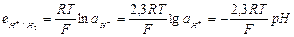 (33.22) Или (33.22) Или 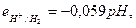 |
Кислородный электрод.Кислородный газовый электрод изображают в виде схемы 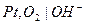 и он имеет конструкцию аналогично водородному электроду. Реакцию, протекающую на кислородном электроде, можно записать:
и он имеет конструкцию аналогично водородному электроду. Реакцию, протекающую на кислородном электроде, можно записать:
Ему отвечает электродная реакция:
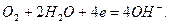
и его электродный потенциал
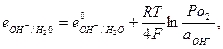
причем в величину е° включена активность воды. Выражение для равновесного кислородного электрода можно записать в виде
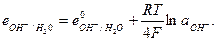
Электроды второго рода представляют собой полуэлементы, состоящие из металла, покрытого слоем его труднорастворимого соединения (соли, оксида или гидрооксида) и погруженного в раствор, содержащий тот же анион, что и труднорастворимое соединение электродного металла (рис. 6).
Например, в хлор-серебряном электроде протекают реакции, в которых участвуют и ионы серебра и ионы хлора:
Ему отвечает электродная реакция:
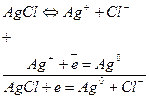
и его электродный потенциал
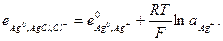 (33.23)
(33.23)
Потенциал электрода второго рода можно рассчитать и по активности аниона: поскольку 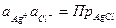 и
и 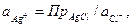
то 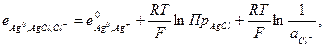 (33.24)
(33.24)
так как произведение растворимости постоянная величина, то ее можно внести в выражение стандартного потенциала
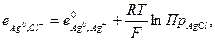
тогда
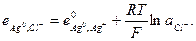 (33.25)
(33.25)
Величины потенциалов электродов второго рода легко воспроизводимы и
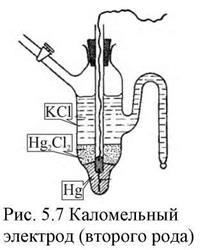 | устойчивы. Эти электроды часто применяются в качестве электродов сравнения, по отношению к которым измеряют потенциалы других электродов. Наиболее часто применяются каломельные электроды 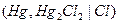 в которых протекает суммарная реакция в которых протекает суммарная реакция 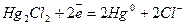 , а так же ртутно-сульфатные, хлор-серебряные, ртутно-окисные и сурьмяные. Окислительно восстановительные или редок- си-электроды , а так же ртутно-сульфатные, хлор-серебряные, ртутно-окисные и сурьмяные. Окислительно восстановительные или редок- си-электроды |
представляют собой, инертную, обычно платиновую пластину, погруженную в раствор, содержащий одновременно, ионы в двух формах окисления (например, 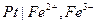 или
или 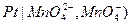 , а электродная реакция сводится к перемене валентности ионов без изменения их состава
, а электродная реакция сводится к перемене валентности ионов без изменения их состава 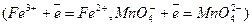 и т.д. Инертный проводник первого рода играет роль донора или акцептора электронов. Для редокс электродов отвечает электродная реакция:
и т.д. Инертный проводник первого рода играет роль донора или акцептора электронов. Для редокс электродов отвечает электродная реакция:
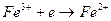
и его электродный потенциал
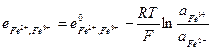 (33.26)
(33.26)
Из других типов электродов следует упомянуть стеклянные электроды, которые находят широкое применение.
Электродвижущая сила
Из полуэлементов, обладающих различными равновесными электродными потенциалами, можно составить электрохимическую систему (рис. 8). По внешней цепи (по проводникам первого рода) электроны переходят с электрода на ион, при этом этот ион восстанавливается. На втором электроде наоборот электроны от иона переходят на электрод и при этом
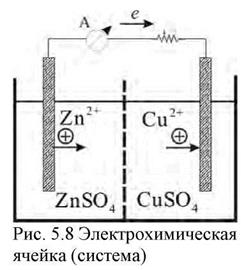 | ион окисляется. При этом энергия реакции превращается в электрическую энергию. Схематически любую электрохимическую систему принято записывать следующим образом: слева указывается тот электрод, на котором идет процесс окисления, затем примыкающий к нему электролит, далее раствор, контактирующий со вторым электродом и, наконец, второй электрод на котором идет процесс восстановления 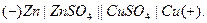 |
При этом в системе протекают реакции:
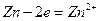
с электродным потенциалом
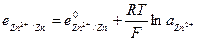
и 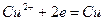 и с электродным потенциалом
и с электродным потенциалом
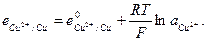
Если ток, протекающий в цепи очень мал (внешнее сопротивление цепи очень велико) электрохимический процесс будет медленным и осуществляться в условиях близких к равновесным. В этом случае работа, совершаемая системой будет близка к максимальной, а разность потенциалов в цепи - наибольшей. Такая наибольшая разность потенциалов в электрохимической цепи называется электродвижущей силой (ЭДС).
ЭДС цепи E представляет собой алгебраическую сумму отдельных скачков потенциала, возникающих на границе раздела между различными фазами, участвующими в образовании цепи. ЭДС рассчитывается как разность потенциалов электродов, на котором идет процесс восстановления 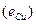 , и электрода на котором идет процесс окисления
, и электрода на котором идет процесс окисления 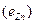 ЭДС всегда положительна:
ЭДС всегда положительна:
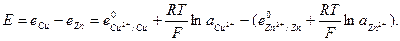 (33.28)
(33.28)
При равновесных потенциалах электродов измеряется стандартная 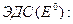
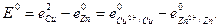 (33.29)
(33.29)
Диффузионный потенциал
В общем случае, при расчете ЭДС цепи следует учитывать не только скачки потенциала на границе между проводниками первого и второго рода, но и на границе между растворами электролитов, возникающими вследствие того, что скорости диффузии катионов и анионов различны. Для двух растворов с одинаковым растворителем такой скачок называется диффузионным потенциалом 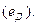 В этом случае ЭДС цепи рассчитывается с учетом диффузионного потенциала:
В этом случае ЭДС цепи рассчитывается с учетом диффузионного потенциала:
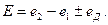 (33.30)
(33.30)
Диффузионный потенциал можно устранить с помощью электролитического мостика, заполненного раствором такого электролита, у которого подвижности аниона и катиона близки по величине (например, 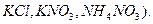
Если диффузионный потенциал между двумя различными растворами полностью устранен, то такие цепи носят название цепей без переноса, и на схеме растворы отделяются друг от друга двумя сплошными вертикальными линиями (||)а если не устранен - вертикальной пунктирной линией  . Цепи, в которых он не устранен и происходит непосредственный перенос электролита из одного раствора в другой, называют цепями с переносом.
. Цепи, в которых он не устранен и происходит непосредственный перенос электролита из одного раствора в другой, называют цепями с переносом.
