Физико-химические свойства углеводородных газов
Нефтяной газ при нормальных условиях – неполярная, аддитивная система (смесь компонентов от С1 до С4). Следовательно, к нему при нормальных условиях применимы аддитивные методы расчётов физико-химических и технологических параметров (Псмеси):
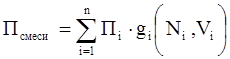 , (3.3)
, (3.3)
где gi – весовая доля;
Ni – мольная доля;
Vi – объёмная доля;
Пi – параметр i-го компонента.
Плотностьсмеси газов рассчитывается следующим образом:
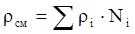 . (3.4)
. (3.4)
При нормальных условиях плотность газа rг = Mi / 22,414.
Нефтяной газ представлен в виде смеси углеводородов, поэтому для оценки его физико-химических свойств необходимо знать, как выражается состав смеси.
Массовая доля (gi) – отношение массы i-го компонента, содержащегося в системе к общей массе системы:
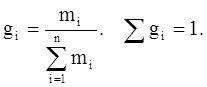 (3.5)
(3.5)
Молярная (мольная) доля (Ni) – отношение числа молей i-го компонента к общему числу молей в системе:
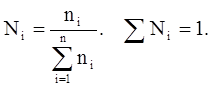 (3.6)
(3.6)
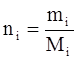 , (3.7)
, (3.7)
где mi – масса i-го компонента;
Мi – молекулярный вес.
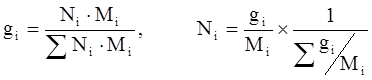 (3.8)
(3.8)
Объёмная доля (Vi) – доля, которую занимает компонент в объёме системы.
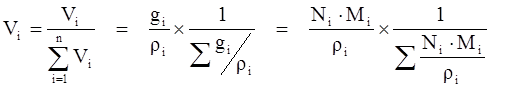 (3.9)
(3.9)
Для идеального газа соблюдается соотношение Vi = Ni .
Молекулярная масса смеси рассчитывается следующим образом:
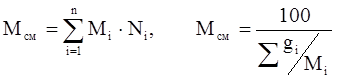 (3.10)
(3.10)
Относительная плотность газа по воздуху:
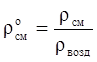 . (3.11)
. (3.11)
Для нормальных условий 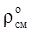 » 1,293; для стандартных условий
» 1,293; для стандартных условий 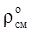 » 1,205.
» 1,205.
Если плотность газа задана при атмосферном давлении (0,1013 МПа), то пересчёт её на другое давление (при той же температуре) для идеального газа производится по формуле:
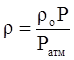 . (3.12)
. (3.12)
Смеси идеальных газов характеризуются аддитивностью парциальных давлений и парциальных объёмов.
Для идеальных газов давление смеси равно сумме парциальных давлений компонентов (закон Дальтона):
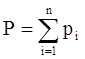 , (3.13)
, (3.13)
где Р – давление смеси газов;
рi – парциальное давление i-го компонента в смеси,
или
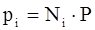 . (3.14)
. (3.14)
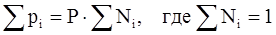 . (3.15)
. (3.15)
Т. е. парциальное давление газа в смеси равно произведению его молярной доли в смеси на общее давление смеси газов.
Аддитивность парциальных объёмов компонентов газовой смеси выражается законом Амага:
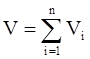 , (3.16)
, (3.16)
где V – объём смеси газов;
Vi – объём i-го компонента в смеси.
или
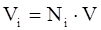 . (3.17)
. (3.17)
Для определения многих физических свойств природных газов используется уравнение состояния.
Уравнением состояния называется аналитическая зависимость между параметрами, описывающими изменение состояние вещества. В качестве таких параметров используется давление, температура, объём.
Состояние газа при стандартных условиях характеризуется уравнением состояния Менделеева-Клайперона:
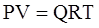 , (3.18)
, (3.18)
где Р – абсолютное давление, Па;
V – объём, м3;
Q – количество вещества, кмоль;
Т – абсолютная температура, К;
R – универсальная газовая постоянная Па×м3/(кмоль×град).
У этого уравнения есть свои граничные условия. Оно справедливо для идеальных газов при нормальном (1 атм.) и близких к нормальному давлениях (10-12 атм.).
При повышенном давлении газ сжимается. За счёт направленности связи С-Н происходит перераспределение электронной плотности, и молекулы газов начинают притягиваться друг к другу.
Для учёта этого взаимодействия в уравнение (3.18) вводится коэффициент сверхсжимаемости z, предложенный голландским физиком Ван-дер-Ваальсом, учитывающий отклонения реального газа от идеального состояния:
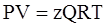 , (3.19)
, (3.19)
где Q – количество вещества, моль.
Физический смысл коэффициента сверхсжимаемости заключается в расширении граничных условий уравнения Клайперона-Менделеева для высоких давлений.
Коэффициент z зависит от давления и температуры, природы газа (критических давлений и температуры).
Критическое давление – давление, при котором газообразный углеводород переходит в жидкое состояние.
Критическая температура – температура, при которой жидкий углеводород переходит в газообразное состояние.
Приведёнными параметрами индивидуальных компонентов называются безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа отклоняются от критических:
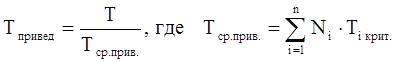 (3.20)
(3.20)
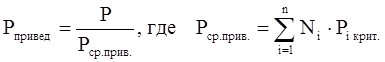 (3.21)
(3.21)
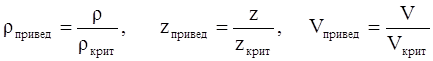 (3.22)
(3.22)
Существуют графики, эмпирические формулы и зависимости для оценки коэффициента сверхсжимаемости от приведенных давлений и приведенных температур.
Зная коэффициент сверхсжимаемости, можно найти объём газа в пластовых условиях по закону Бойля-Мариотта:
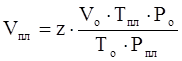 . (3.23)
. (3.23)
Объёмный коэффициент газа используется при пересчёте объёма газа в нормальных условиях на пластовые условия и наоборот (например, при подсчёте запасов):
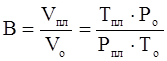 (3.24)
(3.24)
Вязкость газа – свойство газа оказывать сопротивление перемещению одной части газа относительно другой.
Различают динамическую вязкость m и кинематическую вязкость n. Кинематическая вязкость учитывает влияние силы тяжести.
Динамическая вязкость зависит от средней длины пробега молекул газа и от средней скорости движения молекул газа:
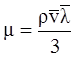 , (3.25)
, (3.25)
где r – плотность газа;
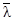 – средняя длина пробега молекулы;
– средняя длина пробега молекулы;
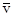 – средняя скорость молекул.
– средняя скорость молекул.
Кинематическая вязкость природного газа при нормальных условиях невелика и не превышает 0,01 сантипуаза.
Динамическая вязкость газа увеличивается с ростом температуры (при повышении температуры увеличивается средняя скорость и длина пробега молекул), однако при давлении более 3 МПа вязкость с ростом температуры начинает снижаться. От давления вязкость газа практически не зависит (снижение скорости и длины пробега молекул при увеличении давления компенсируется ростом плотности).
