Межмолекулярная дегидратация
Спирты способны взаимодействовать между собой с отщеплением воды - за счет гидроксила одной молекулы спирта и атома водорода гидроксигруппы второй молекулы. Таким образом, при участии двух молекул спирта возможна межмолекулярная дегидратация с образованием простого эфира. Реакция протекает при относительно низких температурах. Обычно наряду с простыми эфирами образуются и алкены из-за процесса частичной внутримолекулярной дегидратации:
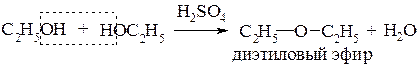
12.3.4.Реакции окисления*
Эти реакции протекают таким образом, что в них одновременно могут участвовать гидроксигруппа и атом водорода, связанный с α-углеродным атомом. Так, если пары спирта пропускать над мелко раздробленной медью или серебром (t=200-300°С), то происходит дегидрирование(отщепление водорода, дегидрогенизация). Первичные спирты превращаются в альдегиды, а вторичные в кетоны:
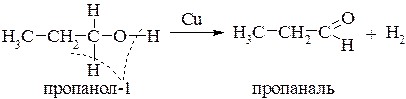
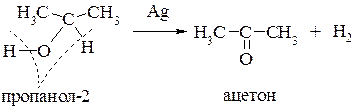
Кроме каталитического дегидрирования окисление можно проводить оксидом еди (II) и такими классическими окислителями, как KMnO4, K2Cr2O7, CrO3 × 2C5H5N (реактив Саррета) и другими.
Из первичных спиртов образуются альдегиды, из вторичных кетоны.
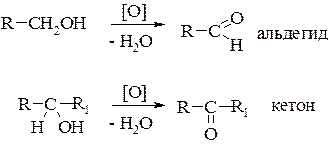
Третичные спирты устойчивы к окислению как в нейтральной, так и щелочной средах. В кислой среде под действием сильных окислителей происходит расщепление С – С связей с образованием нескольких продуктов окисления, каждый из которых содержит меньше углеродных атомов, чем исходный спирт.
Механизм окисления спиртов под действием хромового ангидрида и хромовой кислоты изучен подробно и включает несколько стадий. В первой стадии образуется сложный эфир, а во второй – происходит окислительно-восстановительное элиминирование, в результате которого образуется альдегид или кетон:
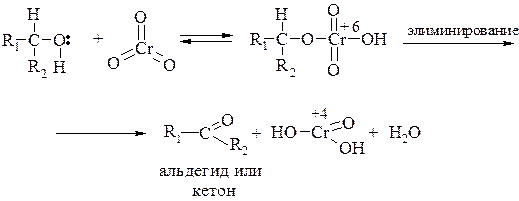
Многоатомные спирты
К многоатомным спиртам относятся соединения, содержащие в молекуле две и более гидроксильные группы.
Диолы, содержащие ОН– группы у двух соседних (вицинальных) атомов углерода, называются гликолями. Известно, что одним из общих методов получения гликолей является окисление алкенов перманганатом калия и это находит отражение в их названиях:
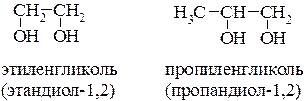
Суффикс «ен» - обычно указывает на наличие двойной углерод-углеродной связи, поэтому во избежание путаницы, а также из-за отсутствия в гликолях непредельной связи, всё же для этих спиртов целесообразно использовать заместительную номенклатуру.
Диолы с двумя гидроксильными группами у соседних третичных атомов углерода, называются пинаконами:
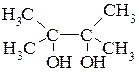
Трехатомные спирты называют глицеринами, четырехатомные – эритритами, пятиатомные – пентитами, шестиатомные – гекситами.
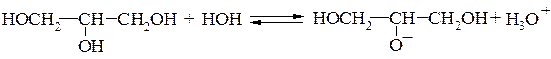
По кислотности многоатомные спирты превосходят одноатомные. Глицерин по кислотности превосходит этиленгликоль. Гидроксигруппа в положении 2 более ионизирована, что объясняется индуктивным эффектом, оказываемым соседними группами в положениях 1 и 3:
Из-за большего количества гидроксильных групп многоатомные спирты ассоциированы в значительно большей степени, чем и объясняется их повышенная растворимость в воде, а также более высокие температуры кипения.
Большинство химических свойств многоатомных спиртов аналогичны одноатомным: они образуют алкоголяты, простые и сложные эфиры, переходят в галогенопроизводные. Здесь же будут рассмотрены некоторые специфические свойства.
Дегидратация
Направление реакции зависит от взаимного расположения гидроксигрупп, а также от условий проведения процесса и природы дегидратирующего агента.
При дегидратации виц-диолов отщепляется 1 моль воды, что приводит к образованию нестабильного енола, который далее трансформируется в альдегид или кетон. Из этандиола образуется ацетальдегид:
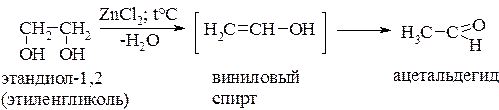
Глицерин отщепляет 2 моля воды с образованием непредельного альдегида – акролеина:
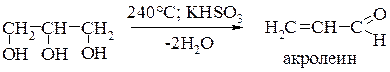
Окисление
Природа окислителя играет важную роль в образовании конечных продуктов. При действии йодной кислоты HIO4 на соединения, содержащие вицинальные гидроксигруппы, происходит разрыв углерод-углеродной связи и образуются альдегиды (если ОН – группы первичные или вторичные) или кетоны (если ОН – группы – третичные):
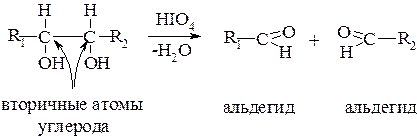
Эта реакция называется гликольным расщеплением. При использовании в качестве окислителей азотной кислоты различной концентрации или пероксида водорода и Fe2+ можно получить разные соединения:
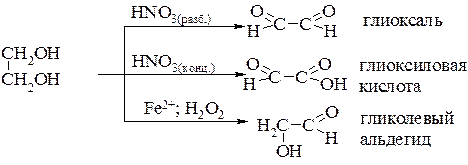
При мягком окислении глицерина образуются два продукта – глицериновый альдегид и дигидроксиацетон:
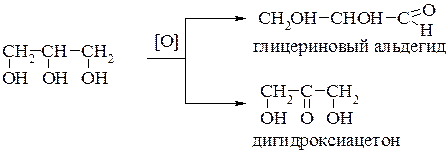
Образование комплексных соединений
Соединения, содержащие виц-диольный фрагмент, взаимодействуют с орто-борной кислотой с образованием комплексных соединений, характеризующихся сильными кислотными свойствами. В реакции участвуют 2 моля виц-диола, что вначале приводит к образованию полного эфира: в этом эфире у одного из виц-диольных остатков имеется гидроксигруппа, которая далее отщепляет протон, что в конечном итоге приводит к комплексному соединению, называемому ансольвокислотой:
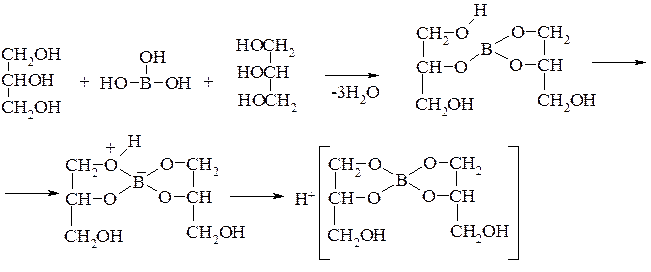
Данная реакция широко используется в фармацевтическом анализе неорганических лекарственных препаратов бора.
Образование комплексов с катионом Cu2+
В отличие от одноатомных спиртов гликоли взаимодействуют с гидроксидом меди (II) с образованием комплексного гликолята меди – синего цвета:
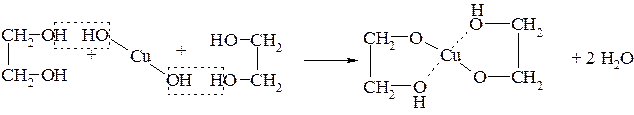
Глицерин взаимодействует с гидроксидами некоторых металлов, в том числе и меди (II), с образованием глицератов. Эта реакция используется для обнаружения многоатомных спиртов:
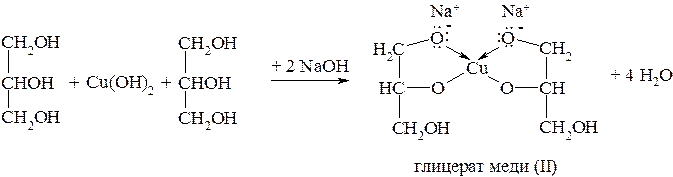
Глицерат меди имеет характерную синюю окраску.
Отдельные представители
Метанол (метиловый, или древесный спирт) – бесцветная прозрачная жидкость, с характерным запахом. Ядовит. Получают сухой перегонкой древесины, а также из оксида углерода (II) и водорода (см. 12.1)
Этанол(этиловый спирт) – бесцветная прозрачная жидкость с характерным запахом. С водой смешивается в любых соотношениях. В промышленности для получения этанола используют гидратацию этилена или восстановление уксуного альдегида, образующегося из ацетилена в результате реакции Кучерова.
Этанол широко применяют в промышленном органическом синтезе: для получения каучука, хлороформа, диэтилового эфира и т.д., а также в качестве растворителя.
Глицерин – бесцветная, вязкая прозрачная жидкость сладкого вкуса. С водой смешивается во всех соотношениях. Очень гигроскопичен, способен поглощать до 40% влаги из воздуха.
Глицерин используют в парфюмерии, в фармации в качестве компонента в кремах и мягких лекарственных формах. Тринитрат глицерина в малых дозах обладает способностью расширять сосуды сердца, поэтому широко применяется в медицинской практике в качестве коронарорасширяющего средства (препарат под названием «нитроглицерин»). Используется также для получения бездымных порохов и других взрывчатых веществ.
Сложные эфиры глицерина и высших жирных кислот широко распространены в природе (жиры, масла, лецитины и кефалины) и имеют важное биологическое значение.
Вопросы для самоподготовки
1. Напишите формулы структурных изомеров, имеющих состав C4H10O. Назовите все вещества по заместительной номенклатуре. Какие из них являются первичными, вторичными и третичными спиртами.
2. Используя в качестве исходных веществ бутанон, этаналь и 2-бромбутан, получите вторбутиловый спирт. Каково отношение этого вещества к окислению.
3. Из пентанола-1 последовательными реакциями получите пентанол-2, а из него пентандиол-2,3. Для последнего напишите формулы всех пространственных изомеров.
4. Объясните почему спирты лучше, чем соответствующие углеводороды растворимы в воде и почему они являются амфотерными соединениями?
5. Обоснуйте возможность или невозможность протекания реакций пропантриола и пропанола-2 с: 1) хлоридом фосфора (V); 2) гидроксидом меди (II); 3) уксусным ангидридом; 4) бензойной кислотой. Какие из них применяются для идентификации полиолов?
6. Напишите уравнения реакций внутримолекулярной дегидратации бутанола-2 и глицерина, а также межмолекулярной дегидратации бутанола-1.
Глава 13. Фенолы
