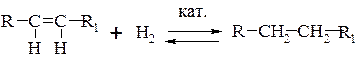Непредельные углеводороды ациклического ряда, содержащие в молекуле одну двойную углерод-углеродную связь, называются алкенами
Принципы номенклатуры алкенов подробно рассмотрены в главе 1, а стереоизомерия – в главе 4. Простейший представитель алкенов – этилен имеет плоское строение с валентными углами, близкими к 120°, что соответствует sp2 – гибридизации обоих атомов углерода (гл. 2, разд. 2). Каждый атом Сsp2 в этилене образует три s-связи – две связи с водородом и одну со вторым атомом Сsp2. За счет бокового перекрывания двух рz-орбиталей (по одной от каждого атома углерода) формируется p-связь, которая имеет плоскость симметрии, совпадающую с плоскостью молекулы (рис. 2.6).
Вращение атомов или атомных групп относительно p-связи затруднено, чем и объясняется существование устойчивых цис-транс изомеров. Взаимный переход этих изомеров друг в друга возможен при УФ-облучении или нагревании. Длина С=С связи в этилене составляет 0,134 нм, что значительно меньше чем в этане (0,154 нм). Следует также отметить, что термохимическая энергия двойной связи в этилене составляет примерно 615 кДж/моль, тогда как энергия s-связи С – С равна примерно 335 кДж/моль. Разница 615 – 335 = 280 кДж/моль – это энергия самой p-связи.
Таким образом энергия связи С=C в этилене меньше, чем сумма энергий двух s-связей, откуда следует, что p-связь разрывается легче, чем s-связь и этот процесс термодинамически выгоден.
Способы получения
Многочисленные методы получения алкенов можно объединить в отдельные группы реакций, позволяющих формировать двойную углерод-углеродную связь.
К первой группе реакций следует отнести реакции элиминирования атомов и атомных групп от двух вицинальных (соседних) углеродных атомов. При элиминировании моногалогенопроизводных и спиртов процесс протекает в соответствии с правилом Зайцева: предпочтительным является образование алкена с наибольшим числом заместителей. Таким образом, отщепление водорода происходит от того соседнего атома углерода, который наименее гидрогенизирован.
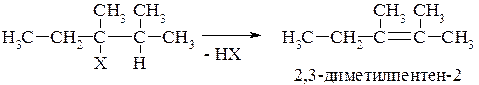
Дегидрогалогенирование – отщепление галогеноводорода под действием спиртового раствора щелочи.
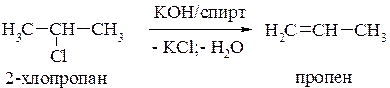
Дегидратация – отщепление воды под действием водоотнимающих реагентов при нагревании.

Легкость элиминирования галогенпроизводных и спиртов уменьшается от третичных к первичным.
Дегалогенирование виц-дигалогенопроизводных под действием активных двухвалентных металлов Mg, Zn и иодида натрия:
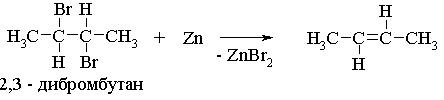
Дегидрирование алканов (см. крекинг алканов):
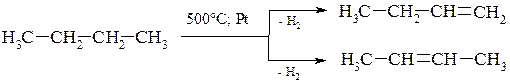
Другая группа реакций основана на стереоселективном восстановлении алкинов до соответствующих цис- или транс-алкенов. Образование преимущественно одного изомера можно регулировать соответствующим катализатором.

Третья группа реакций основана на конденсации карбонилсодержащих соединений с метиленактивными молекулами:
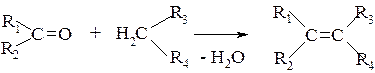
Физические свойства
Алкены по своим физическим свойствам мало отличаются от алканов с тем же числом углеродных атомов. Температуры кипения изменяются с такими же закономерностями, что и в алканах.
Низшие гомологи алкенов – газы при обычных условиях, а, начиная с углеводорода С5Н10, – низкокипящие жидкости. Алкены, как и алканы, практически нерастворимы в воде, но растворимы в неполярных органических растворителях.
Химические свойства алкенов
Двойная связь легко поляризуема и является донором электронов. Легкость разрыва p-связи свидетельствует о том, что для алкенов наиболее характерны реакции присоединения, что можно представить в общем виде:

Гидрирование алкенов
В обычных условиях алкены не взаимодействуют с водородом из-за высокой энергии активации процесса присоединения.
По тепловому эффекту реакция является экзотермической и протекает с достаточной скоростью лишь в присутствии металлических катализаторов (Pt, Pd, Ni, Os и др.).