Относительная и абсолютная конфигурация
В стереохимической номенклатуре используют две системы обозначения стереоизомеров – D,L и R,S. В D/L-системе описывается только относительная конфигурация соединений, поскольку она основана на сравнении конфигурации анализируемого оптически активного вещества с конфигурацией эталонного вещества.
В качестве таких эталонных веществ используют D- и L-глицериновый альдегид (для описания конфигурации гидроксикислот и моносахаридов), а также D- и L-серин (при описании конфигурации аминокислот).
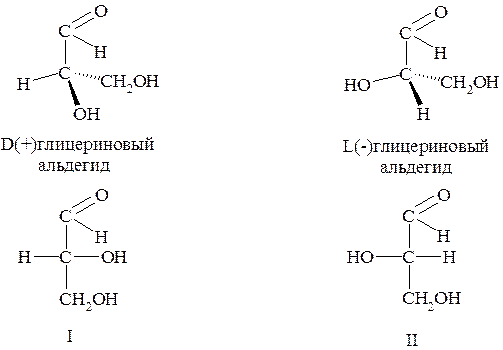
Заметим, что правовращающему (+) глицериновому альдегиду произвольно была приписана структура I, а левовращаемому (-) глицериновому альдегиду – структура II. Префиксы D (от «dextrum» - правый) и L (от «laevus» - левый) придаются названию веществ по определению и относятся исключительно к конфигурации хирального центра.
Когда хотят обозначить принадлежность вещества к D- или L- конфигурационным рядам, пользуются проекционными формулами Фишера, в которых углеродную цепь ориентируют вертикально. При этом альдегидную или эквивалентную ей по старшинству группу (например, -СООН) изображают вверху, а группу -СН2ОН (или вместо неё -СН3) располагают снизу. Далее определяют направление движения от атома водорода в хиральном центре к гидрогсигруппе через альдегидную (или карбоксильную) группу. Аналогичную операцию проводят и с изомерной формулой.
Если направление движения от Н к ОН вокруг хирального центра совпадает с направлением движения часовой стрелки, то формуле приписывают префикс D; если же движение противоположно часовой стрелке – то префикс L.
Таким образом, данная система обозначений позволяет только лишь относить стереоизомеры к D- или L-конфигурационным рядам без каких-либо намёков на вращение.
Следовательно, не обязательно, чтобы, например, вещество, относящееся к D-конфигурационному ряду, вращало плоскость поляризации вправо, а L-ряда – влево. Так, левовращающая молочная кислота относится к D-конфигурационному ряду, а правовращающая – к L-ряду. В таких случаях знаками «+» или «-» после символов D и L указывают соответствующее вращение:
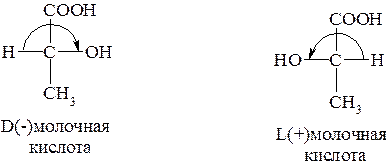
В настоящее время номенклатурные правила IUPAC не запрещают использовать D/L систему обозначений стереоизомеров в химии углеводов и аминокислот.
Для молекул, содержащих несколько хиральных центров, число оптических изомеров будет соответствовать формуле N=2n, где N-количество возможных изомеров, а n – число асимметрических углеродных атомов. Однако, если такая молекула обладает некоторыми элементами симметрии, то число изомеров будет меньше.
Рассмотрим в качестве примера винную (дигидроксиянтарную) кислоту, содержащую два асимметрических углеродных атома.
Пользуясь D/L системой обозначений, напишем все возможные изомеры:
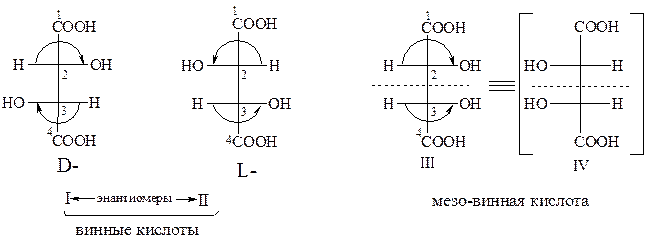
Известны четыре формы винных кислот:
I – (+) винная кислота, которая встречается в природе;
II – (-) винная кислота, полученная из виноградной кислоты;
III, IV – мезовинная (или антивинная кислота).
Структуры I и II соотносятся между собой как зеркальные изомеры, т.е. являются оптическими антиподами.
Структура III – мезовинная кислота – имеет плоскость симметрии, которая обозначена пунктирной линией: она оптически неактивна. Таким образом, в мезовинной кислоте имеет место «внутренняя компенсация» знака вращения.
Из представленных структур видно, что I, II и III различны между собой.
Соединения I и II являются энантиомерами (антиподами). Пары веществ I и III, а также II и III являются диастереомерами. Обращает на себя внимание тот факт, что у таких пар веществ конфигурация одного хирального центра одинакова (для I и III – это С-2; II и III – это С-3), а у другого разная (для I и III – это С-3; II и III – это С-2).
Таким, образом, диастереомеры – это пространственные изомеры, отличающиеся конфигурацией части имеющихся в них элементов хиральности и не являющиеся оптическими антиподами.
Рассмотренный тип диастереомерии обозначается как σ-диастереомерия.
Для соединений с двумя асимметрическими атомами иногда используют способ обозначения диастереомеров по аналогии с эритрозой и треозой. Различие между ними заключается в расположении одинаковых атомов или групп атомов относительно плоскости σ-связи между асимметрическими атомами углерода.

Обобщая изложенное выше, можно заключить, что экспериментальное определение знака вращения с помощью поляриметра не позволяет ответить на вопрос, какой энантиомер конкретно соответствует данному знаку вращения.
Об истинном расположении атомов или атомных групп вокруг хирального центра судят по абсолютной конфигурации.
В настоящее время существуют лишь два независимых метода определения абсолютной конфигурации – это рентгеноструктурный анализ и теоретический расчёт.
Для обозначения абсолютной конфигурации используют более строгую систему описания стереоизомеров, известную под названием R,S-номенклатуры (от латинского rectus – правый; sinister – левый) Кана-Ингольда-Прелога. В основе этой системы лежит принцип последовательного уменьшения старшинства заместителей. Суть этих правил сводится к следующим положениям.
1. Для атомов, непосредственно связанных с асимметрическим атомом углерода, старшинство убывает в порядке уменьшения порядкового номера элемента:
53I > 35Br > 17Cl > 9F > 1H; OH > NH2 > CH3 > H
2. В том случае, когда старшинство нельзя определить с помощью правила 1, то его необходимо определять по порядковому номеру второго (или последующего) атома:
CH2Cl > CH2OH > CH2NH2 > CH2CH3 > CH3;
CH2CH2OH > CH2CH2NH2 > CH2CH2CH3.
3. Если второй, или последующий атомы одинаковы, но число таких атомов различное, то старшим считается группа, которая содержит больше заместителей с большим порядковым номером:
CHCl2 > CH2Cl
4. В том случае, когда заместитель, связанный с асимметрическим атомом, содержит кратные связи, то каждый из атомов при двойной связи считается за два, а при тройной связи - за три:
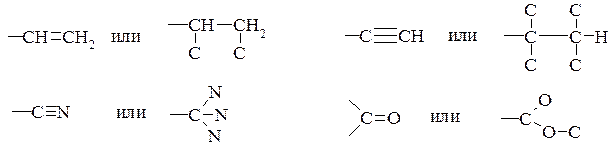
тогда старшинство убывает в следующей последовательности:
–СООСН3 > –COOH > –CONH2 > –COCH3 > –CHO> –C≡N > –C≡CH > –CH=CH2
Для отнесения молекулы к R- или S-системе заместители у асимметрического атома углерода Хabcd располагают в порядке убывания старшинства, исходя из того, что a > b > c > d. Хиральный центр рассматривают так, чтобы самый младший заместитель d был максимально удалён от наблюдателя. Если у оставшихся трёх заместителей a, b, c старшинство убывает по часовой стрелке, то конфигурация хирального центра получает символ R (от латинского rectus – правый). Если же старшинство заместителей убывает против часовой стрелки, то конфигурация хирального центра получает символ S (от латинского sinister – левый).
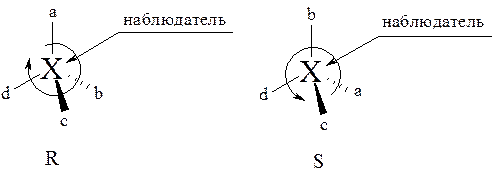
Пользуясь правилами старшинства заместителей, можно понять, что (+) молочная кислота имеет S-конфигурацию, а (+) глицериновый альдегид имеет R-конфигурацию.
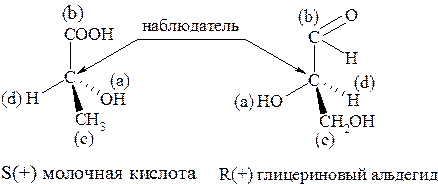
Экспериментальное определение абсолютной конфигурации правовращающей винной кислоты показало, что у обоих асимметрических атомов конфигурация соответствует R, а левовращающей – S. У мезовинной кислоты R (у С-2) и S (у С-3).
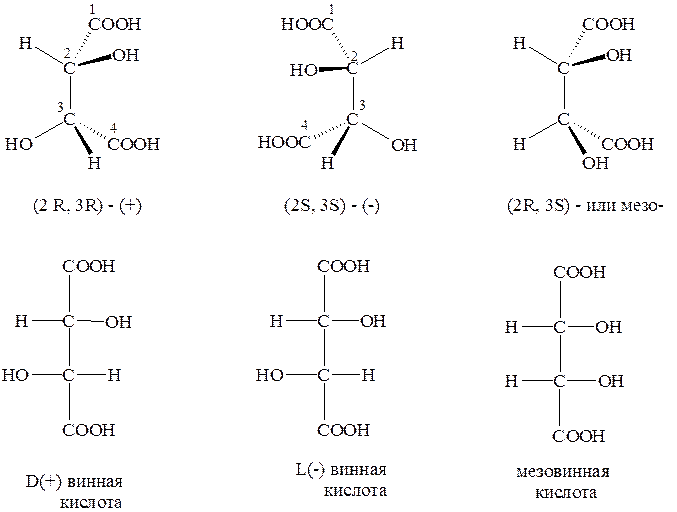
Причиной хиральности органических молекул может быть не только наличие асимметрических атомов углерода.
Если рассматривать 1,3-дизамещённые циклобутаны, или 1,4-дизамещённые циклогексаны, то можно убедиться, что они имеют только одну плоскость симметрии. При этом заместители могут располагаться по разные стороны от плоскости цикла.
В приведённых ниже примерах одинаковые по старшинству заместители в каждой паре располагаются по одну или по разные стороны цикла, что в стереохимии обозначается соответственно префиксами цис- и транс-. Такие пары стереоизомеров также являются диастереомерами.
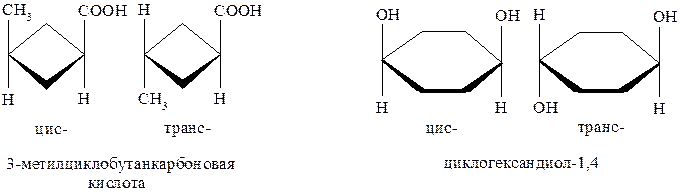
Для алкенов также характерна цис- транс- изомерия. Устойчивость этих изомеров объясняется прежде всего тем, что π-связь препятствует свободному вращению атомов или атомных групп по оси σ-связи между атомами углерода. Переход одного изомера в другой возможен при высоких температурах, УФ-облучении и т.п.
Данный вид изомерии в алкенах называют цис- транс- или геометрической изомерией, а такие пары веществ являются π-диастереомерами.
В более общем случае для алкенов, отвечающих общей формуле abC=Ccd, должно соблюдаться условие a≠b и c≠d, хотя возможно a=c и b=d.
Использование префиксов цис- и транс- целесообразно лишь тогда, когда a=c и b=d:

Всё же по современной номенклатуре IUPAC более предпочтительно использование E,Z-системы, основанной на учёте правил последовательного старшинства заместителей. Та конфигурация, в которой по одну сторону от плоскости π-связи располагаются старшие заместители, обозначают префиксом «Z» (от немецкого zusammen – вместе). Конфигурация, в которой старшие заместители находятся по разные стороны от плоскости π-связи, обозначают префиксом «Е» (от немецкого entgegen – напротив).
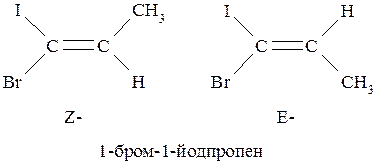
Если молекула содержит несколько двойных связей, то префиксы Z- и Е- указывают с соответствующей цифрой, характеризующей положение конкретной двойной связи:
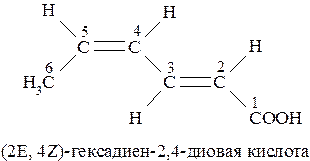
Если при нумерации цепи может возникнуть возможность разночтения, то преимущество в выборе наименьших числовых обозначений (локантов) получает та двойная связь, которая имеет Z-конфигурацию (Z-группы старше Е):
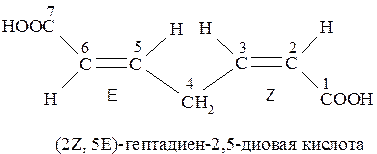
Вопросы для самоподготовки
1. Два изомера алкана имеют состав С8H18 . Первый содержит в молекуле один асимметричный атом С, другой – два . Назовите эти алканы и приведите формулы Фишера для их пространственных изомеров. Объясните, какой из них обладает оптической активностью?
2. Определите тип гибридизации атомов углерода в 2-метилпентадиене-1,3 и 2-метилпентадиене-1,4. Для какого из них возможна геометрическая изомерия? Назовите эти изомеры.
3. Напишите формулу изомеров веществ, приведенных в пункте 2, в которых есть только один sp –гибридный атом углерода.
4. Объясните понятия энантиомер и диастереомер на примере винной кислоты.
5. Какой принцип лежит в основе отнесения веществ к D,L-конфигурационным рядам?
6. Как используется старшинство заместителей при построении R,S-конфигурационных рядов?
Глава 5. Алканы
Алканы* (предельные, насыщенные углеводороды) – это наиболее простой класс органических соединений, отвечающий общей формуле CnH 2n+2. Здесь атомы углерода находятся только в состоянии sp3-гибридизации. Каждый атом углерода в алканах удобно классифицировать с точки зрения числа связанных с ним других углеродных атомов, что иллюстрируется примерами:

Атомы углерода, связанные только с одним углеродным атомом, называются первичными (во всех трёх соединениях – это концевые метильные группы, а также CH3 группы в положениях 2,4 соединения II и в положениях 2,2 соединения III).
Если атом углерода связан с двумя другими атомами углерода, то он называется вторичным (атомы С-2, С-3, С-4 в соединении I; С-3 в соединении II и С-3, С-4 в соединении III).
Атом, связанный с тремя другими атомами углерода, называется третичным (атом С-2 и С-4 в соединении II).
Наконец, когда атом связан с четырьмя другими атомами углерода, то он считается четвертичным (C-2 в соединении III).
Способы получения
Главными промышленными источниками получения алканов являются природный газ и нефть. Переработку нефти и различных её фракций в промышленности осуществляют преимущественно таким методом как крекинг.
Совокупность реакций, происходящих при термическом распаде алканов, называют крекингом. Данный процесс, сопровождающийся гомолитическим разрывом С-С и С-Н связей, приводит к образованию промежуточных радикалов, из которых далее образуются низкомолекулярные алканы, алкены и карбоциклы.
Сn H 2n+2 → Сm H 2m+2 + Cp H 2p.
При крекинге метана (t≈800°C) образуется смесь, преимущественно состоящая из ацетилена и водорода:
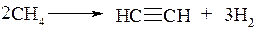
Этан в этих условиях разлагается в соответствии с суммарной реакцией
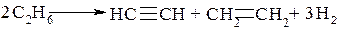
Очень важно отметить, что промышленная переработка нефти, как наиболее богатого и разнообразного по составу источника углеводородов, в большей степени, к сожалению, служит нуждам энергетики, а также сгорает в двигателях внутреннего сгорания.
Путём термического крекинга возможно расщепление алканов керосиновой фракции (С10 - С15) и солярной фракции (С12 – С20). Однако, полученный таким путём бензин невысокого качества (октановое число не более 65).
На современных перерабатывающих предприятиях термический крекинг практически полностью заменён каталитическим крекингом. Он обычно проводится в газовой фазе (400-450°С) и под давлением 10-15 атм в присутствии алюмосиликатного катализатора.
Большое практическое значение получил синтез углеводородов из оксида углерода (II) и водорода (метод Фишера-Тропша). При температурном режиме 250°С и в присутствии никелевого катализатора получают метан:
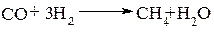
Если в качестве катализатора использовать железо и кобальт, то можно получать смесь углеводородов (синтин), содержащих от 12 до 18 углеродных атомов:

Кроме природных источников получения алканов широко используют и многочисленные синтетические способы, которые можно разделить на три группы.
Первую группу составляют реакции, в которых исходные вещества и конечные продукты содержат одинаковое число атомов углерода. К ним относятся следующие реакции:
а) гидрирование непредельных углеводородов:
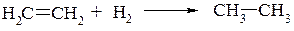
б) восстановление галогенопроизводных водородом или йодоводородом
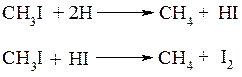
Ко второй группе реакций относят реакции, при которых полученный продукт содержит больше углеродных атомов, чем исходное вещество. Особо следует отметить взаимодействие галогенопроизводных с металлическим натрием (реакция Вюрца):
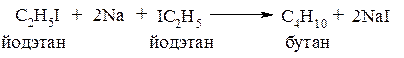
Данная реакция более интересна с точки зрения получения симметричных алканов из двух молей одинаковых исходных соединений. Если же исходными веществами являются разные галогенопроизводные, то, как правило, образуется смесь трёх алканов:
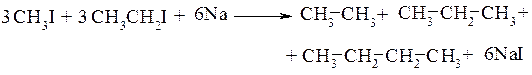
Модифицированный вариант этой реакции, называемой реакциейВюрца-Фиттига, используют для получения алкилзамещённых аренов (см. 10.1.)
Для наращивания цепи углеродных атомов применяют реакцию Кольбе, которая по сути представляет собой электролиз солей одноосновных карбоновых кислот. Кислотный остаток на аноде окисляется до радикала CH3COO•, который далее распадается с образованием CO2 и алкильного радикала. Два таких радикала, соединяясь, образуют алкан:
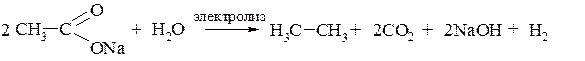
К третьей группе относятся реакции, при которых полученный продукт содержит меньше углеродных атомов, чем исходное соединение. Примером такого способа является расщепление солей карбоновых кислот при сплавлении с щёлочью:
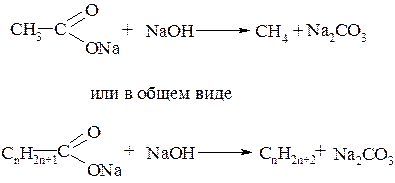
Физические свойства
Углеводороды, содержащие от одного до четырёх атомов углерода, – газы. Соединения с С5 и до С17 – жидкости, а выше – твёрдые вещества.
С увеличением длины цепи на один атом углерода температуры кипения углеводородов повышаются на 20-30°С, за исключением метана, этана и пропана. Нормальные алканы (т.е. с неразветвлённой цепью) имеют более высокие температуры кипения, чем их изомеры. Алканы неполярны и поэтому практически нерастворимы в воде, но хорошо растворяются в неполярных и малополярных органических растворителях. В чистом виде они бесцветны и имеют слабый запах
Химические свойства алканов
В обычных условиях углеводороды ряда метана характеризуются высокой химической инертностью, что, прежде всего, связано с прочностью С-С и С-Н связей. Более того, связи С-Н практически неполярны из-за близких значений электроотрицательностей: Сsp3=2.5; H=2.1 по шкале Полинга. Очень низкая поляризуемость связи С-Н говорит о том, что для гетеролитического разрыва такой связи требуется значительная энергия. Расчёты свидетельствуют, что энергия гомолитического разрыва связи С-Н примерно в три раза меньше, чем гетеролитического. По этой причине для алканов более предпочтительны гомолитические реакции с образованием промежуточных частиц – радикалов.
Галогенирование
Хлорирование метана можно представить в виде последовательных реакций замещения:
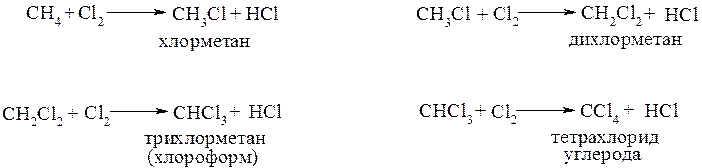
Заметно реакция начинает развиваться, если смесь метана с хлором нагреть до 200°С или облучить УФ-светом. При более высокой температуре и/или ультрафиолетовом облучении реакция протекает очень быстро.
Хлорирование метана и других алканов является типичной цепной радикальной реакцией.
При высокой температуре (≈400°С) и/или интенсивном облучении происходит гомолитическое расщепление связей.
Молекула хлора расщепляется на два атома (гомолитический разрыв связи). Эта стадия называется зарождением цепи, поскольку образующиеся радикалы далее вызывают цепь последовательных реакций, протекающих по SR-механизму:
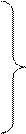
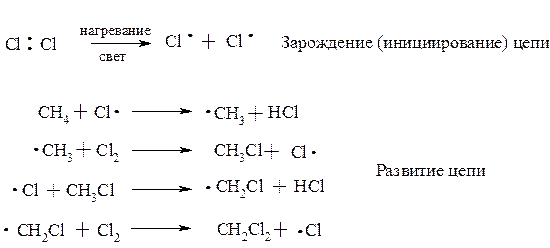
Возможен и другой процесс – обрыв цепи: два метильных радикала взаимодействуют между собой, рекомбинируясь в этан, а два атома хлора – в молекулу Cl2:
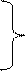
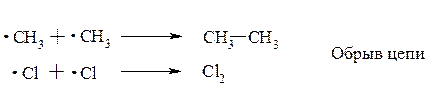
Процесс галогенирования относится к цепным химическим реакциям*.
Аналогичные реакции происходят при взаимодействии метана с фтором и бромом, причём реакционная способность галогенов изменяется в такой последовательности: F2>Cl2>Br2. Реакция с фтором протекает со взрывом в темноте при комнатной температуре, поэтому процесс ведут на холоду и в присутствии благородного газа.
Взаимодействие алканов с бромом осуществляется с высокой избирательностью, вследствие чего образуется преимущественно один изомер.
Если алкан имеет разветвлённое строение и содержит первичные, вторичные и третичные атомы углерода, то при галогенировании замещение преимущественно происходит по третичному углеродному атому.
При изменении температурного режима реакция хлорирования протекает по-разному: инициируемое облучением хлорирование пропана при 25°С приводит к смеси продуктов:

В реакции хлорирования избирательность замещения увеличивается с понижением температуры.
При бромировании образующийся радикал брома менее реакционоспособен и избирательность замещения очень высока:
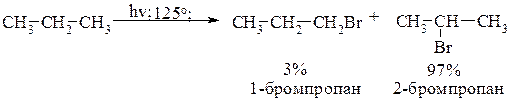
Нитрование. Нитрование алканов под действием 10-20%-й азотной кислоты при нагревании впервые осуществлено М.И. Коноваловым (1888г.). В этой связи данный процесс называется реакцией Коновалова. Такой способ нитрования является жидкофазным., так как проводится при 150º С и под давлением. Например, в этих условиях можно получить 2-нитрогексан с выходом 63%.
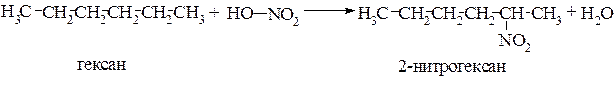
В условиях реакции Коновалова селективность нитрования аналогична галогенированию, т.е. в первую очередь легче замещается водород у третичного углеродного атома, затем вторичного и труднее всего у первичного.
В дальнейшем был предложен метод парофазного нитрования при температуре 400-500°С. Данный метод имеет существенный недостаток: из-за высокой температуры происходит разрыв С-С -связей (крекинг), что приводит к образованию сложной смеси продуктов замещения.
Известно, что в азотной кислоте всегда присутствует NO2, высокая химическая активность которого обусловлена сильной поляризацией молекулы и наличием неспаренного электрона. В условиях парофазного нитрования именно эта частица запускает реакцию, что можно представить в виде следующих последовательных процессов:
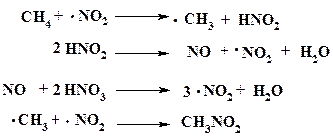
Стабильность радикала ·NO2 в этих условиях высока и он быстро реагирует с метильным радикалом. Следствием этого является низкая концентрация ·СH3 в реакционной смеси, что в свою очередь сводит к минимуму развитие побочных радикальных реакций.
Сульфохлорирование. Взаимодействие алканов с оксидом серы IV в присутствии хлора называется сульфохлорированием и относится к цепным реакциям. В общем виде процесс можно представить в виде реакций:
CH3–(CH2)n–CH3 + SO2 + Cl2 → CH3–(CH2)n– CH2–SO2Cl + HCl
Механизм реакции аналогичен галогенированию:
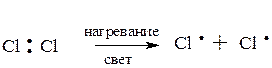
CH3–(CH2)n–CH3 + Cl· → CH3–(CH2)n–CH2· + HCl
CH3–(CH2)n–CH2· + SO2 → CH3 (CH2)n–CH2SO2·
CH3–(CH2)n–CH2SO2· + Cl2 → CH3–(CH2)n–CH2SO2Cl + Cl·
Реакция сульфохлорирования широко используется в производстве моющих средств на основе углеводородов, содержащих 12 – 18 атомов углерода.
Дегидрирование. При высоких температурах (≈650°С) алканы могут подвергаться дегидрированию. В зависимости от типа катализатора (металлы или оксиды металлов) из алкана образуется либо алкен, либо алкадиен. Данная реакция используется при дегидрировании бутан – бутеновой фракции переработки нефти:
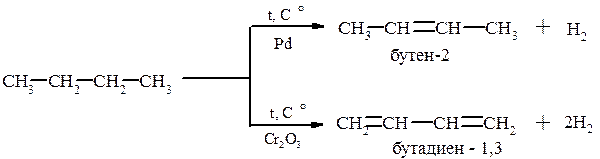
2-Метилбутан, содержащийся в изопентан–изопентеновой фракции переработки нефти, переходит в изопрен:
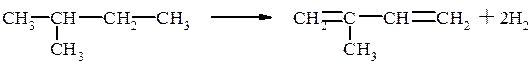
При дегидрировании фракций переработки нефти, содержащих шесть или более атомов углерода, возможно образование циклических соединений, в том числе и ароматических:
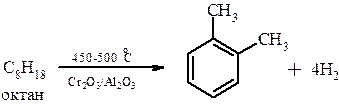
Это метод дегидрирования называется дегидроциклизацией алканов и ароматизацией нефти.
Изомеризация алканов. Под влиянием кислот Льюиса и при высоких температурах н-алканы, начиная с бутана, могут переходить (изомеризоваться) в изоалканы и наоборот. Чем больше углеродных атомов, тем легче изомеризация. Обычно образуется равновесная смесь:
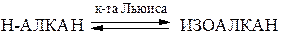
Окисление. В избытке кислорода и при температуре выше 300°С алканы легко сгорают с образованием CO2 и H2O. Реакция экзотермическая и сопровождается выделением большого количества теплоты:
CH4 + 2O2 → CO2 + H2O; Δ H = -804 кДж/моль
В обычных же условиях сильные окислители не действуют на алканы.
Окисление алканов в жидкой или газообразной фазе кислородом или воздухом при температуре 150 – 200° С сопровождается разрывом углерод - углеродных связей и образованием преимущественно карбоновых кислот в качестве конечных продуктов. Таким путём, например, из бутана можно получить уксусную кислоту:
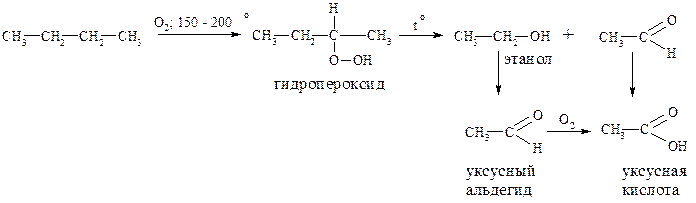 Вопросы для самоподготовки
Вопросы для самоподготовки
1. Напишите формулу и название изомера октана, в состав которого входят только первичные и четвертичные атомы углерода. Предложите схему его синтеза из 2-метилпропана.
2. Путём последовательных реакций получите из ацетата натрия изобутан. Напишите для него уравнения реакций нитрования (по Коновалову) и бромирования. Объясните механизм этих реакций и причину, по которой преимущественно образуются третичные нитро- и бромпроизводные.
3. На смесь хлорметана и 2-хлорпрорпана подействовали металлическим натрием. В результате получили смесь трёх алканов. Напишите формулы и названия этих алканов.
4. Получите 2-метилбутан из соответствующего алкина. Напишите для него уравнения реакций сульфоокисления и сульфохлорирования. Сколько изомерных продуктов образуется в каждой из этих реакций?
5. На 1,3-дибром-2-метилпропан последовательно подействовали 1) цинком; 2) бромоводородом; 3) металлическим натрием. Напишите уравнения всех реакций, назовите все соединения.
6. Запишите уравнения реакций, с поощью которых из метана получают п-аминобензойную кислоту.
Глава 6. Алкены
