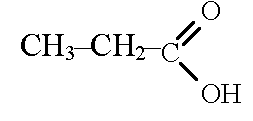Роль белков в питании. Превращение белков в органах пищеварительной системы. Роль соляной кислоты в переваривании белков. Характеристика протеолитических ферментов пищеварительного тракта.
Главными источниками белков для человека являются пищевые продукты животного и растительного происхождения. Главным образом - животного (мясо, рыба, сыр) и только некоторые растительные (горох, соя) продукты богаты белками, в то время как наиболее распространенные растительные пищевые продукты содержат небольшие количества его.
Пищевую ценность белка характеризует аминокислотный состав. Чем выше содержание незаменимых аминокислот, тем больше пищевая ценность белка.
• Незаменимые– Триптофан, Фенилаланин, Лизин, Треонин, Метионин, Лейцин, Изолейцин, Валин; • Условно заменимые – Тирозин, Цистеин; • Частично заменимые - Гистидин, Аргинин; • Заменимые - Глицин, Аланин, Серин, Глутамат, Глутамин, Аспартат, Аспарагин, Пролин.
Весь сложный процесс переваривания пищевых белков в пищеварительном тракте «настроен» таким образом, чтобы путем последовательного действия протеолитических ферментов лишить белки пищи видовой и тканевой специфичности и придать продуктам распада способность всасываться в кровь через стенку кишечника.
Гидролиз заключается в разрыве пептидных связей — СО — NH — белковой молекулы.
Переваривание белков.Пищевые белки подвергаются гидролитическому расщеплению под влияниемпротеолитических ферментов:класс – гидролазы, подкласс – пептидазы.Данные ферменты (эндо- и экзопептидазы)вырабатывается в неактивной форме, т.е. вформе проферментов, а затемактивируются путём частичного протеолиза.Это предохраняет стенки пищеварительноготракта от самопереваривания. В ротовой полости белки не подвергаются каким-либо химическим превращениям, т.к. здесь отсутствуют ферменты, действующие на белки. В желудке начинается химическое превращение белков. Здесь действуют два основных фермента: пепсин и гастриксин. Пепсин вырабатывается главными клетками слизистой оболочки желудка в неактивной форме - пепсиногена, который под действием соляной кислоты активируется и превращается в активный пепсин. Под влиянием соляной кислоты пепсиноген активируется медленно. Более быстро активация происходит под влиянием пепсина, т.е. процесс активации является аутокаталитическим механизм активации пепсиногена – частичный протеолиз. От пептидной цепи неактивного пепсиногена со стороны N-конца отрывается один пептид, содержащий 42 аминокислоты. Затем из остатка цепи формируется новая трёхмерная структура фермента - пепсина и новый активный центр фермента. Соляная кислота вырабатывается обкладочными клетками слизистой желудка и играет очень важную роль в переваривании белков: 1.) Активирует пепсиноген, превращая его в пепсин; 2.) Создаёт оптимум рН для действия пепсина (1,5 - 2); 3.) Обладает бактерицидным действием; 4.) Денатурирует белки; 5.) Способствует продвижению желудочного содержимого далее в кишечник.
Пепсин - это фермент, который является эндопептидазой, т.е. действует на внутренние пептидные связи, в образовании которых участвуют аминогруппы ароматических аминокислот (ФЕН, ТИР, ТРИ).
-ала–гли–фен–асп- Гастриксин по действию аналогичен пепсину, эндопептидаза, оптимум рН = 3-3,5. Действует на пептидные связи, в образовании которых участвуют дикарбоновые аминокислоты (ГЛУ, АСП) своими карбоксильными группами.
-цис–асп–сер–ала-
В желудке под действием пепсина и гастриксина сложные белковые молекулы распадаются на высокомолекулярные полипептиды, которые поступают в тонкий кишечник. В тонком кишечнике эти полипептиды подвергаются действию целого ряда протеолитических ферментов поджелудочной железы, которые вырабатываются в неактивной форме: трипсиноген, химотрипсиноген, проэластаза, прокарбоксипептидаза.
• В кишечнике эти ферменты путем частичного протеолиза превращаются в активные ферменты: трипсин, химотрипсин, эластаза, карбоксипептидаза. • Активация трипсиногена происходит под влиянием фермента эпителия кишечника – энтеропептидазы. • Этот фермент отщепляет с N-конца трипсиногена гексапептид.
Изменение конформации оставшейся части фермента приводит к формированию активного центра и образованию активного трипсина. Образовавшийся трипсин активирует остальные ферменты.
• трипсин, химотрипсин, эластаза - эндопептидазы. • трипсин разрушает внутренние пептидные связи, в образовании которых принимают участие карбоксильные группы лиз и арг. • химотрипсин разрушает внутренние связи, в образовании которых принимают участие карбоксильные группы ароматических аминокислот (тир, три, фен). • эластаза разрушает внутренние пептидные связи, в образовании которых принимают участие аминокислоты с небольшой боковой цепью (-гли–ала-).
Карбоксипептидаза разрушает наружные пептидные связи, отщепляя аминокислоты с С-конца полипептидной цепи (экзопептидаза). Подробно изучены две карбоксипептидазы – АиВ, относящиеся к металлопротеинам и катализирующие отщепление от полипептида С-концевых аминокислот. Карбоксипептидаза А разрывает преимущественно пептидные связи, образованные концевыми ароматическими аминокислотами, а карбоксипептидаза В – связи, в образовании которых участвуют С-концевые лизин и аргинин.
Аминопептидазы. В кишечном соке открыты два фермента – аланинаминопептидаза, катализирующая преимущественно гидролиз пептидной связи, в образовании которой участвует N-концевой аланин, и лейцинаминопептидаза, не обладающая строгой субстратной специфичностью и гидролизующая пептидные связи, образованные любой N-концевой аминокислотой. Оба фермента осуществляют ступенчатое отщепление аминокислот от N-конца полипептидной цепи.
Дипептидазы. Процесс переваривания пептидов, их расщепление до свободных аминокислот в тонкой кишке завершают дипептидазы. Среди дипептидаз кишечного сока хорошо изучена глицилглициндипептидаза, гидролизующая соответствующий дипептид до двух молекул глицина. Известны также две другие дипептидазы: пролил-дипептидаза (пролиназа), катализирующая гидролиз пептидной связи, в образовании которой участвует СООН-группа пролина, и пролин-дипептидаза (пролидаза), гидролизующая дипептиды, в которых азот пролина связан кислотно-амидной связью.
Отделение панкреатического и кишечного соков регулируется нейрогормональными факторами. Имеются доказательства роли соляной кислоты в качестве пускового механизма выработки в кишечнике особых гормонов. В частности, соляная кислота, попадая в двенадцатиперстную кишку, стимулирует секрецию секретина; последний, стимулируя секрецию и отделение щелочного панкреатического сока, способствует оттоку желчи. Секретин быстро исчезает из кровотока, а новые порции его не вырабатываются, поскольку соляная кислота нейтрализуется щелочным панкреатическим соком.
Таким образом, благодаря существованию такого механизма, действующего по типу обратной связи, осуществляется регуляция секреции и отделения поджелудочного сока. Поджелудочный сок, полученный при действии секретина, содержит незначительное количество ферментов, но богат бикарбонатами, создающими слабощелочную среду (рН 7,5–8,5), оптимальную для действия пищеварительных ферментов в кишечнике.
Вторым гормоном, также синтезирующимся в двенадцатиперстной кишке и регулирующим секрецию поджелудочного сока, является холецистокинин (панкреозимин); он стимулирует отделение сока, богатого ферментами и бедного бикарбонатами.
Примерно 95–97% белков пищи всасывается в виде свободных аминокислот. Следовательно, ферментный аппарат пищеварительного тракта осуществляет поэтапное, строго избирательное расщепление пептидных связей белковой молекулы вплоть до конечных продуктов гидролиза белков – свободных аминокислот.
Транспорт аминокислот в клетки.Аминокислоты, образовавшиеся при гидролизе белков подвергаются всасыванию в кишечнике. Аминокислоты поступают в энтероцит путем симпорта с ионами натрия. Далее специфическая транслоказапереносит аминокислоту из энтероцита в кровь. Обмен ионов натрия между клетками осуществляется путем первично-активного транспорта с помощью Na+, K+-АТФ-азы.
В настоящее время известно 5 транспортных систем, функционирующих для переноса определенных групп аминокислот:

Одна из специфических транспортных систем функционирует в мозге, кишечнике, почках. Она получила название гаммаглутамильный цикл. Система состоит из одного мембранного и 5 цитоплазматических ферментов. Ключевую роль играет мембраносвязанный фермент гаммаглутамилтрансфераза.
Этот фермент является гликопротеином и катализирует перенос гаммаглутамильной группы глутатиона на транспортируемую аминокислоту и последующий перенос комплекса в клетку. Аминокислота оказывается внутри клетки. После распада комплекса и высвобождения аминокислоты происходит регенерация глутатиона. Источники и пути использования аминокислот.
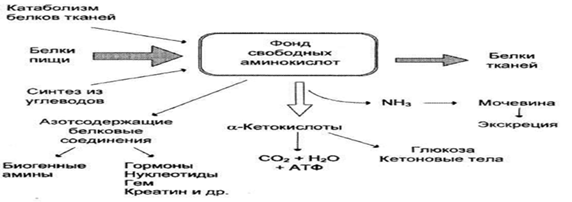
Метаболизм аминокислот.
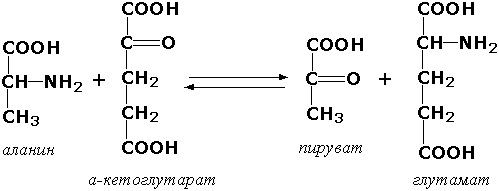
Несмотря на то, что почти для каждой аминокислоты выяснены индивидуальные пути обмена, известен ряд превращений, общих для многих аминокислот: • трансаминирование; • декарбоксилирование; • дезаминирование.
22. Гниение белков и аминокислот в кишечнике. Примеры реакций дезаминирования, декарбоксилирования, десульфирования аминокислот. Распад углеводородных цепей на примере тирозина и триптофана.
Не всосавшиеся аминокислоты поступают в толстую кишку, где подвергаются процессам гниения. Это процесс бактериального распада веществ под действием микрофлоры или ферментов, вырабатывающихся этой микрофлорой. В норме в толстой кишке подвергаются аминокислоты, а при патологии - белки. Это происходит и в других отделах ЖКТ: в желудке (при понижении кислотности), ротовой полости (при кариесе).
Белки АК Диамины
Фенол Крезол Н2S NH3 CO2 CH4 Меркаптаны Скатол Индол
Реакции декарбоксилирования: Орнитин в состав белков не входит, но обязательно содержится в организме.
| Путресцин и кадаверин являются токсическими веществами. Они входят в состав трупных ядов. |
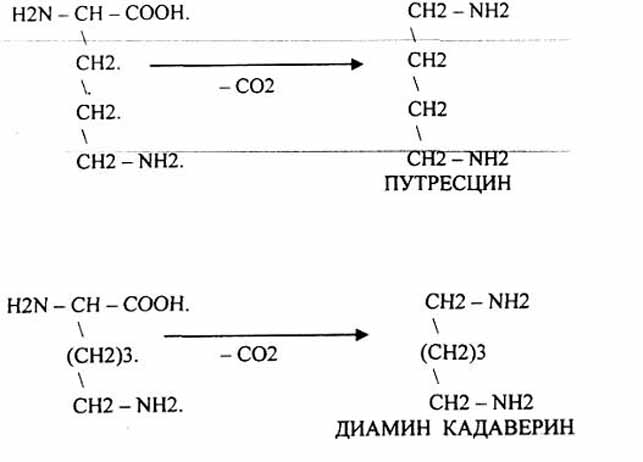
| Лизин |

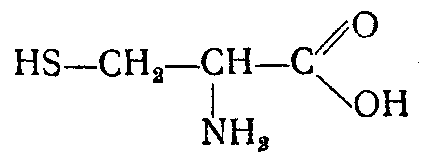
Восстановительное дезаминирование: Десульфирование - восстановительный процесс.
| -Н2S |
| 2Н+ |
| Цистеин |
| Аланин |
| -NH3 |
| 2Н+ |
| Пропионовая кислота |
| Аланин |