Характерные особенности ковалентной связи
Насыщаемость.Если два атома водорода образовали ковалентную связь посредством объединения своих неспаренных электронов, то присоединение третьего атома водорода уже невозможно. В случае соединения трёх атомов водорода в области связывания окажутся три электрона, а так как область связывания (перекрывания) принадлежит каждой из трёх орбиталей атомов водорода, то окажется, что на каждой орбитали будет находиться три электрона, что противоречит принципу Паули(никакие два электрона в одном атоме не могут иметь четыре одинаковых квантовых числа, т. е. не могут находиться в одинаковом квантовом состоянии).
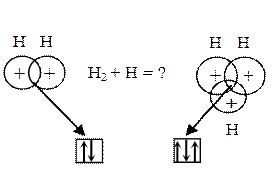
В области связывания трёх электроотрицательных атомов водорода может находиться только два электрона с противоположными спинами. Если удалить один электрон, то образуется реально существующий ион Н3+, в котором в области перекрывания будет два электрона с противоположными спинами.
Принцип Паули запрещает использование одной и той же АО дважды в образовании химических связей. Если же у атома имеется несколько орбиталей с неспаренными электронами, то возможно образование таких молекул, как О3, S8, Р4 и др.
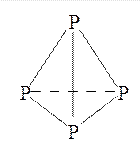
Например, образование тетраэдрической молекулы Р4 происходит за счёт перекрывания трёх р-орбиталей каждого из четырёх атомов фосфора по обменному механизму с р-орбиталями трёх других атомов фосфора, каждая из которых содержит по одному неспаренному электрону:
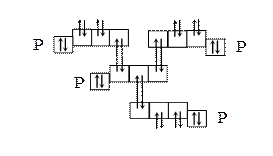
Таким образом, взаимодействие двух атомов, приводящее к образованию ковалентных связей, своей насыщаемостью отличается от взаимодействия электрических зарядов и больших масс (силы тяготения), которые не являются насыщаемыми. Если положительный заряд притягивается к одному отрицательному заряду, то это не мешает ему притягиваться и к другим отрицательным зарядам. Вследствие насыщаемости ковалентной связи молекулы имеют определённый химический состав.
Направленностьобусловленаперекрыванием атомных орбиталей вдоль прямой линии, проведённой через ядра взаимодействующих атомов.
Направленные ковалентные связи называются одинарными или сигма-связями (σ-связь). Между двумя атомами в молекуле возможна только одна σ-связь. Все σ-связи обладают осевой симметрией относительно межъядерной оси, и фрагменты молекулы могут вращаться вокруг этой оси без нарушения степени перекрывания орбиталей, т. е. без деформации σ-связи. Так как σ-связи строго ориентированы в пространстве, то в зависимости от состава молекулы они могут находиться под определённым углом друг к другу (валентный угол).Например, в молекуле Н2S две σ-связи S–Н, образованные по обменному механизму перекрыванием s-орбиталей атомов водорода и р-орбиталейатома серы, находятся под углом 92°. Совокупность направленных, строго ориентированных в пространстве σ-связей создаёт пространствен-ную структуру молекулы.
σ-связьможет быть образована перекрыванием двух s-орбиталей (σs-s-связь), двух р-орбиталей (σр-р-связь), одной s- и одной р-орбиталями(σs-p-связь); возможно также образование σs-d -, σp-d – и σd-d связей.
Целочисленность.Если два атома имеют по нескольку неспаренных электронов и ковалентная связь между ними осуществляется более чем одной парой электронов, то между этими атомами образуются кратные (двойные, тройные) связи. Кратные связи могут образовывать атомы С, N, О. Например, в молекуле N2 атомы азота с электронной конфигурацией 2s22р3 образуют одну σ-связь и две π-связи. Образование π-связей происходит при перекрывании атомных орбиталей, расположенных перпендикулярно или под иными углами к σ-связи и параллельно друг к другу.
С появлением π-связи, не имеющей осевой симметрии, свободное вращение фрагментов молекулы вокруг σ-связи прекращается. Любой поворот одного из связанных π-связью атомов вокруг межъядерной оси (вокруг σ-связи) приведёт к разрыву π-связи.
Если электроны, образующие π-связь, имеют равную нулю вероятность нахождения в плоскости молекулы, то такую плоскость называют узловой.
Перекрывание орбиталей в случае π-связей меньше, чем в случае σ-связей. Поэтому π-связи, как правило, слабее σ-связей. Электроны π-связи легче вырываются из молекулы и, следовательно, придают ей бόльшую реакционную способность.
Примеры соединенийс двойными и тройными связями: диоксид углерода СО2 (О=С=О), монооксид углерода СО (:С≡О:), азот N2 (:N≡N:) и др.
Кратность связи(или порядок связи ω) определяется числом пар электронов между атомами, участвующими в её образовании. В молекулах этана H3C:CH3, этена H2C::СH2 и этина НС::СН значение ω соответственно равно 1, 2, 3. Увеличение кратности связи приводит к усилению ковалентной связи и уменьшению её длины.
