Оптические свойства дисперсных систем
При падении света на дисперсную систему могут наблюдаться следующие явления:
прохождение светачастицами дисперсной фазы (наблюдается для прозрачных систем, в которых частицы много меньше длины волны падающего света (r << λ);
преломление светачастицами дисперсной фазы (если эти частицы прозрачны);
отражение светачастицами дисперсной фазы (если частицы непрозрачны);
преломление и отражениесвета наблюдается для систем, в которых частицы много больше длины волны падающего света (r >> λ). Визуально это явление выражается в мутности этих систем;
рассеяние светанаблюдается для систем, в которых частицы дисперсной фазы меньше, но соизмеримыс длиной волны падающего света (r ≈ 0,1 λ);
адсорбция(поглощение) света дисперсной фазой с превращением световой энергии в тепловую.
Уравнение Рэлея:
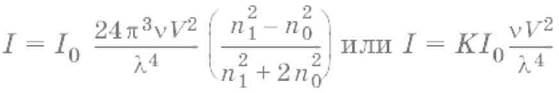
где I, I0 – интенсивность рассеянного и падающего света; V – объем одной частицы; ν – частичная концентрация (число частиц в единице объема); λ – длина волны; n1, n0 – показатели преломления частиц и среды соответственно.
Явление различной окраски коллоидного раствора в проходящем и рассеянном (отраженном) свете называется опалесценцией.В случае окрашенных растворов происходит наложение собственной окраски и окраски, вызванной опалесценцией (явление дихроизма света).
7.3. Молекулярно‑кинетические свойства
Для коллоидных систем характерно броуновское движение – непрерывное беспорядочное движение частиц микроскопических и коллоидных размеров. Это движение тем интенсивнее, чем выше температура и чем меньше масса частицы и вязкость дисперсионной среды.
Диффузия – самопроизвольно протекающий процесс выравнивания концентрации частиц.
Закон Фика:
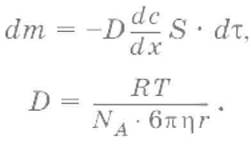
Вследствие большого размера коллоидных частиц диффузия в коллоидных системах замедленна по сравнению с истинными растворами.
Осмотическое давление:
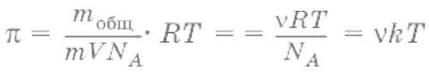
где mобщ – масса растворенного вещества; m – масса одной частицы; V – объем системы; NA – число Авогадро; Т – абсолютная температура; ν – частичная концентрация; k – постоянная Больцмана.
Для сферических частиц:
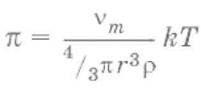
где νm – масса дисперсной фазы в единице объема раствора; ρ – плотность дисперсионной среды; r – радиус частиц.
Строение мицеллы
Мицеллой лиофобнойсистемы называется гетерогенная микросистема, которая состоит из микрокристалла дисперсной фазы, окруженного сольватированными ионами стабилизатора.
Потенциалопределяющиминазываются ионы, адсорбирующиеся на поверхности частички твердой фазы (агрегата)и придающие ей заряд. Агрегат вместе с потенциалопределяющими ионами составляет ядро мицеллы.
Противоионы – ионы, группирующиеся вблизи ядра мицеллы.
Расположение противоионов в дисперсионной среде определяется двумя противоположными факторами: тепловым движением (диффузией) и электростатическим притяжением.
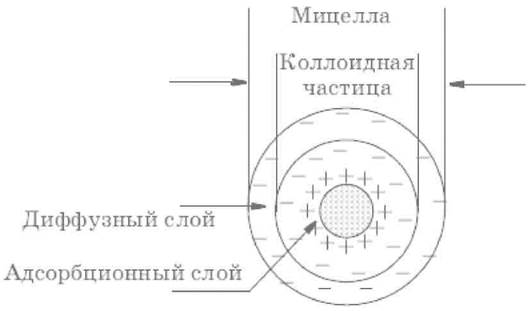
Противоионы, входящие в состав плотного адсорбционного слоя,называются «связанными» и вместе с ядром составляют коллоидную частицу, или гранулу. Коллоидная частица (гранула) имеет заряд, знак которого обусловлен знаком заряда потенциалопределяющих ионов.
Противоионы, образущие диффузный слой, – «подвижные», или «свободные».
Коллоидная частица с окружающим ее диффузным слоем сольватированных про‑тивоионов составляют мицеллу.В отличие от коллоидной частицы мицелла электронейтральна и не имеет строго определенных размеров.

В мицелле с ионным стабилизатором на границе раздела фаз имеется ДЭС, возникает разность потенциалов между дисперсной фазой и дисперсионной средой – термодинамический потенциалф (межфазный),который определяется свойствами данной дисперсной системы, а также зарядом и концентрацией потенциалопределяющих ионов, адсорбированных на твердой фазе.
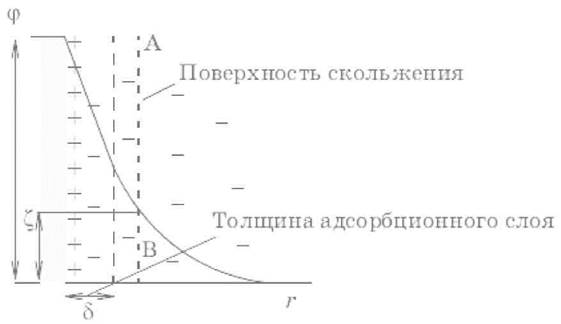
Перемещение заряженных коллоидных частиц в неподвижной жидкости к одному из электродов под действием внешнего электрического поля называется электрофорезом.
Поверхность, по которой происходит перемещение, называется поверхностью скольжения.Величина скачка потенциала на границе фаз, находящихся в движении относительно друг друга при электрофорезе и в броуновском движении, т. е. на поверхности скольжения, называется электрокинетическим или ζ‑потенциалом (дзета‑потенциал).
Устойчивость и коагуляция
Устойчивость дисперсных системхарактеризует способность дисперсной фазы сохранять состояние равномерного распределения частиц во всем объеме дисперсионной среды.
Существует два вида относительной устойчивости дисперсных систем: седимента‑ционная и агрегативная.
Седиментационная устойчивость – способность системы противостоять действию силы тяжести. Седиментация – это оседание частиц в растворе под действием силы тяжести.
Условие седиментационного равновесия:частица движется с постоянной скорость, т. е. равномерно,сила трения уравновешивает силу тяжести:
6πηrU = 4/3πr3(ρ – ρ0)g,
где ρ – плотность дисперсной фазы, ρ0 – плотность дисперсионной среды, g – ускорение силы тяжести, η – вязкость среды.
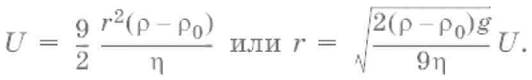
Агрегативная устойчивостьхарактеризует способность частиц дисперсной фазы противодействовать их слипанию между собой и тем самым сохранять свои размеры.
При нарушении агрегативной устойчивости происходит коагуляция – процесс слипания частиц с образованием крупных агрегатов.В результате коагуляции система теряет свою седиментационную устойчивость, т. к. частицы становятся слишком крупными и не могут участвовать в броуновском движении.
Причины коагуляции:
> изменение температуры;
> действие электрического и электромагнитного полей;
> действие видимого света;
> облучение элементарными частицами;
> механическое воздействие;
> добавление электролита и др.
Наибольший практический интерес вызывает коагуляция электролитами.
