Строение атома и Периодический закон
Стр 34
I. Общая химия
Основные понятия химии
Химия – наука о составе, строении, свойствах и превращениях веществ.
Атомно‑молекулярное учение.Вещества состоят из химических частиц (молекул, атомов, ионов), которые имеют сложное строение и состоят из элементарных частиц (протонов, нейтронов, электронов).
Атом – нейтральная частица, состоящая из положительного ядра и электронов.
Молекула – устойчивая группа атомов, связанных химическими связями.
Химический элемент – вид атомов с одинаковым зарядом ядра. Элемент обозначают

где X – символ элемента, Z– порядковый номер элемента в Периодической системе элементов Д.И. Менделеева, A – массовое число. Порядковый номер Zравен заряду ядра атома, числу протонов в ядре атома и числу электронов в атоме. Массовое число Aравно сумме чисел протонов и нейтронов в атоме. Число нейтронов равно разности A – Z.
Изотопы – атомы одного элемента, имеющие разные массовые числа.
Относительная атомная масса(Ar) – отношение средней массы атома элемента естественного изотопического состава к 1/12массы атома изотопа углерода 12С.
Относительная молекулярная масса(Mr) – отношение средней массы молекулы вещества естественного изотопического состава к 1/12 части массы атома изотопа углерода 12С.
Атомная единица массы(а.е.м) – 1/12часть массы атома изотопа углерода 12С. 1 а.е. м = 1,66 × 10‑24г.
Моль – количество вещества, содержащее столько структурных единиц (атомов, молекул, ионов), сколько содержится атомов в 0,012 кг изотопа углерода 12С. Моль – количество вещества, содержащее 6,02 • 1023структурных единиц (атомов, молекул, ионов).
n = N/NA,где n – количество вещества (моль), N – число частиц, a NA – постоянная Авогадро. Количество вещества может обозначаться также и символом v.
Постоянная Авогадро NA =6,02 • 1023частиц/моль.
Молярная массаM(г/моль) – отношение массы вещества m(г) к количеству вещества n(моль):
М = m/n,откуда: m = М • nи n = m/М.
Молярный объем газаVM(л/моль) – отношение объема газа V(л) к количеству вещества этого газа n(моль). При нормальных условиях VM =22,4 л/моль.
Нормальные условия:температура t =0°C, или Т =273 К, давление р =1 атм = 760 мм. рт. ст. = 101 325 Па = 101,325 кПа.
VM = V/n, откуда: V = VM• nи n = V/VM.
В результате получается общая формула:
n = m/M = V/VM = N/NA.
Эквивалент– реальная или условная частица, взаимодействующая с одним атомом водорода, или замещающая его, или эквивалентная ему каким‑либо другим способом.
Молярная масса эквивалентов Мэ– отношение массы вещества к количеству эквивалентов этого вещества: Мэ = m/n(экв).
В реакциях обмена зарядов молярная масса эквивалентов вещества

с молярной массой Мравна: Мэ = М/(n × m).
В окислительно‑восстановительных реакциях молярная масса эквивалентов вещества с молярной массой Мравна: Мэ = М/n(ē),где n(ē) – число переданных электронов.
Закон эквивалентов– массы реагирующих веществ 1 и 2 пропорциональны молярным массам их эквивалентов. m1/m2= МЭ1/МЭ2,или m1/МЭ1 = m2/МЭ2,или n1 = n2,где m1и m2– массы двух веществ, МЭ1и МЭ2 – молярные массы эквивалентов, n1 и n2– количества эквивалентов этих веществ.
Для растворов закон эквивалентов может быть записан в следующем виде:
cЭ1 • V1 = cЭ2 • V2, где сЭ1, сЭ2, V1и V2– молярные концентрации эквивалентов и объемы растворов этих двух веществ.
Объединенный газовый закон: pV =nRT,где p – давление (Па, кПа), V– объем (м3, л), n– количество вещества газа (моль), T –температура (К), T(К) = t(°C) + 273, R– константа, R =8,314 Дж/(К × моль), при этом Дж = Па • м3= кПа • л.
Химическая связь
Метод валентных связей
Согласно методу валентных связей, связь между атомами А и В образуется с помощью общей пары электронов.

Ковалентная связь.

Донорно‑ацепторная связь.
Валентность характеризует способность атомов образовывать химические связи и равна числу химических связей, образованных атомом. Согласно методу валентных связей, валентность равна числу общих пар электронов, а в случае ковалентной связи валентность равна числу неспаренных электронов на внешнем уровне атома в его основном или возбужденных состояниях.
Валентность атомов
Например, для углерода и серы:

Насыщаемостьковалентной связи: атомы образуют ограниченное число связей, равное их валентности.
Гибридизация атомных орбиталей– смешение атомных орбиталей (АО) разных подуровней атома, электроны которых участвуют в образовании эквивалентных σ‑связей. Эквивалентность гибридных орбиталей (ГО) объясняет эквивалентность образующихся химических связей. Например, в случае четырехвалентного атома углерода имеется один 2s–и три 2p‑электрона. Чтобы объяснить эквивалентность четырех σ‑связей, образованных углеродом в молекулах CH4, CF4 и т. д., атомные одна s‑ и три р‑орбитали заменяют четырьмя эквивалентными гибридными sp3‑орбиталями:

Направленностьковалентной связи состоит в том, что она образуется в направлении максимального перекрывания орбиталей, образующих общую пару электронов.
В зависимости от типа гибридизации гибридные орбитали имеют определенное расположение в пространстве:
sp– линейное, угол между осями орби‑талей 180°;
sp2– треугольное, углы между осями орбиталей 120°;
sp3– тетраэдрическое, углы между осями орбиталей 109°;
sp3d1– тригонально‑бипирамидальное, углы 90° и 120°;
sp2d1– квадратное, углы между осями орбиталей 90°;
sp3d2– октаэдрическое, углы между осями орбиталей 90°.
Некоторые виды связей
Ионная связь – электростатическая связь между ионами противоположных зарядов. Ионная связь может рассматриваться как предельный случай ковалентной полярной связи. Ионная связь образуется, если разница электроотрицательностей атомов ΔХ больше чем 1,5–2,0.
Ионная связь является ненаправленной ненасыщаемойсвязью. В кристалле NaCl ион Na+притягивается всеми ионами Cl¯ и отталкивается всеми другими ионами Na+, независимо от направления взаимодействия и числа ионов. Это предопределяет большую устойчивость ионных кристаллов по сравнению с ионными молекулами.
Водородная связь– связь между атомом водорода одной молекулы и электроотрицательным атомом (F, CI, N) другой молекулы.
Существование водородной связи объясняет аномальные свойства воды: температура кипения воды гораздо выше, чем у ее химических аналогов: tкип(Н2O) = 100 °С, а tкип(H2S) = ‑61°C. Между молекулами H2S водородные связи не образуются.
Термохимия
Энергия(Е)– способность производить работу. Механическая работа (А) совершается, например, газом при его расширении: А = р • ΔV.
Реакции, которые идут с поглощением энергии, – эндотермические.
Реакции, которые идут с выделением энергии, – экзотермические.
Виды энергии:теплота, свет, электрическая, химическая, ядерная энергия и др.
Типы энергии:кинетическая и потенциальная.
Кинетическая энергия – энергия движущегося тела, это работа, которую может совершить тело до достижения им покоя.
Теплота (Q)– вид кинетической энергии – связана с движением атомов и молекул. При сообщении телу массой (m)и удельной теплоемкостью (с) теплоты ΔQ его температура повышается на величину Δt: ΔQ = m • с • Δt,откуда Δt = ΔQ/(c • т).
Потенциальная энергия – энергия, приобретенная телом в результате изменения им или его составными частями положения в пространстве. Энергия химических связей – вид потенциальной энергии.
Первый закон термодинамики:энергия может переходить из одного вида в другой, но не может исчезать или возникать.
Внутренняя энергия (U)– сумма кинетической и потенциальной энергий частиц, составляющих тело. Поглощаемая в реакции теплота равна разности внутренней энергии продуктов реакции и реагентов (Q = ΔU = U2 – U1),при условии, что система не совершила работы над окружающей средой. Если реакция идет при постоянном давлении, то выделяющиеся газы совершают работу против сил внешнего давления, и поглощаемая в ходе реакции теплота равна сумме изменений внутренней энергии ΔU и работы А = р • ΔV.Эту поглощаемую при постоянном давлении теплоту называют изменением энтальпии: ΔН = ΔU + р • ΔV,определяя энтальпиюкак Н = U + pV.Реакции жидких и твердых веществ протекают без существенного изменения объема (ΔV =0), так что для этих реакций ΔНблизка к ΔU (ΔН = ΔU). Для реакций с изменением объема имеем ΔН > ΔU, если идет расширение, и ΔН < ΔU, если идет сжатие.
Изменение энтальпии обычно относят для стандартного состояния вещества: т. е. для чистого вещества в определенном (твердом, жидком или газообразном) состоянии, при давлении 1 атм = 101 325 Па, температуре 298 К и концентрации веществ 1 моль/л.
Стандартная энтальпия образования ΔНобр– теплота, выделяемая или поглощаемая при образовании 1 моль вещества из простых веществ, его составляющих, при стандартных условиях. Так, например, ΔНобр(NaCl) = ‑411 кДж/моль. Это означает, что в реакции Na(тв) + ½Cl2(г) = NaCl(тв) при образовании 1 моль NaCl выделяется 411 кДж энергии.
Стандартная энтальпия реакции ΔН– изменение энтальпии в ходе химической реакции, определяется по формуле: ΔН =ΔНобр(продуктов) – ΔНобр(реагентов).
Так для реакции NH3(г) + HCl(г) = NH4Cl(тв), зная ΔHo6p(NH3)=‑46 кДж/моль, ΔHo6p(HCl) = ‑92 кДж/моль и ΔHo6p(NH4Cl) = ‑315 кДж/моль имеем:
ΔH = ΔHo6p(NH4Cl) – ΔHo6p(NH3) – ΔHo6p(HCl) = ‑315 – (‑46) – (‑92) = ‑177 кДж.
Если ΔН <0, то реакция экзотермическая. Если ΔН >0, то реакция эндотермическая.
ЗаконГесса: стандартная энтальпия реакции зависит от стандартных энтальпий реагентов и продуктов и не зависит от пути протекания реакции.
Самопроизвольно идущие процессы могут быть не только экзотермическими, т. е. процессами с уменьшением энергии (ΔН <0), но могут быть и эндотермическими процессами, т. е. процессами с увеличением энергии (ΔН >0). Во всех этих процессах «беспорядок» системы увеличивается.
ЭнтропияS– физическая величина, характеризующая степень беспорядка системы. S – стандартная энтропия, ΔS – изменение стандартной энтропии. Если ΔS > 0, беспорядок растет, если AS < 0, то беспорядок системы уменьшается. Для процессов в которых растет число частиц, ΔS > 0. Для процессов, в которых число частиц уменьшается, ΔS < 0. Например, энтропия меняется в ходе реакций:
СаО(тв) + Н2O(ж) = Са(OH)2(тв), ΔS < 0;
CaCO3(тв) = СаО(тв) + CO2(г), ΔS > 0.
Самопроизвольно идут процессы с выделением энергии, т. е. для которых ΔН <0, и с увеличением энтропии, т. е. для которых ΔS > 0. Учет обоих факторов приводит к выражению для энергии Гиббса: G = Н – TSили ΔG = ΔН – Т • ΔS.Реакции, в которых энергия Гиббса уменьшается, т. е. ΔG < 0, могут идти самопроизвольно. Реакции, в ходе которых энергия Гиббса увеличивается, т. е. ΔG > 0, самопроизвольно не идут. Условие ΔG = 0 значит, что между продуктами и реагентами установилось равновесие.
При низкой температуре, когда величина Тблизка к нулю, идут лишь экзотермические реакции, так как TΔS – мало и ΔG = ΔН <0. При высоких температурах значения TΔSвелико, и, пренебрегая величиной ΔН,имеем ΔG = – TΔS,т. е. самопроизвольно будут идти процессы с увеличением энтропии, для которых ΔS > 0, a ΔG < 0. При этом чем больше по абсолютной величине значение ΔG, тем более полно проходит данный процесс.
Величина AG для той или иной реакции может быть определена по формуле:
ΔG = ΔСобр(продуктов) – ΔGoбp(реагентов).
При этом величины ΔGoбр, а также ΔНобри ΔSoбр для большого числа веществ приведены в специальных таблицах.
Химическая кинетика
Скорость химической реакции(v) определяется изменением молярной концентрации реагирующих веществ в единицу времени:
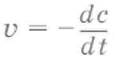
где v– скорость реакции, с – молярная концентрация реагента, t– время.
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции (температуры, концентрации, присутствия катализатора и т. д.)
Влияние концентрации. Вслучае простых реакций скорость реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам.
Для реакции
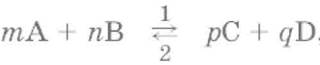
где 1 и 2 соответственно направление прямой и обратной реакции:
v1 = k1× [А]m × [В]nи
v2 = k2 × [C]p × [D]q
где v – скорость реакции, k– константа скорости, [А] – молярная концентрация вещества А.
Молекулярность реакции– число молекул, участвующих в элементарном акте реакции. Для простых реакций, например: mA + nB→ рС + qD,молекулярность равна сумме коэффициентов (m + n). Реакции могут быть одномолекулярными, двумолекулярными и редко трехмолекулярными. Реакции более высокой молекулярности не встречаются.
Порядок реакцииравен сумме показателей степеней концентрации в экспериментальном выражении скорости химической реакции. Так, для сложной реакции
mA + nB → рС + qDэкспериментальное выражение скорости реакции имеет вид
v1 =k1× [А]α× [В]βи порядок реакции равен (α + β). При этом α и β находятся экспериментально и могут не совпадать с mи nсоответственно, поскольку уравнение сложной реакции представляет собой итог нескольких простых реакций.
Влияние температуры.Скорость реакции зависит от числа эффективных столкновений молекул. Увеличение температуры увеличивает число активных молекул, сообщая им необходимую для протекания реакции энергию активацииЕакт и увеличивает скорость химической реакции.
Правило Вант‑Гоффа.При увеличении температуры на 10° скорость реакции увеличивается в 2–4 раза. Математически это записывается в виде:
v2 = v1× γ(t2 – t1)/10
где v1 и v2 – скорости реакции при начальной (t1) и конечной (t2) температурах, γ – температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции при увеличении температуры на 10°.
Более точно зависимость скорости реакции от температуры выражается уравнением Аррениуса:
k = A × e–E/(RT),
где k – константа скорости, А – постоянная, не зависящая от температуры, е = 2,71828, Е– энергия активации, R =8,314 Дж/(К × моль) – газовая постоянная; Т– температура (К). Видно, что константа скорости увеличивается с увеличением температуры и уменьшением энергии активации.
Химическое равновесие
Система находится в равновесии, если ее состояние не изменяется во времени. Равенство скоростей прямой и обратной реакции – условие сохранения равновесия системы.
Примером обратимой реакции является реакция
N2 + 3H2 ↔ 2NH3.
Закон действия масс:отношение произведения концентраций продуктов реакции к произведению концентраций исходных веществ (все концентрации указывают в степенях, равных их стехиометрическим коэффициентам) есть постоянная, называемая константой равновесия.
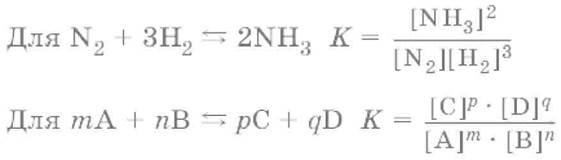
Константа равновесия – это мера протекания прямой реакции.
К =О – прямая реакция не идет;
К =∞ – прямая реакция идет до конца;
К >1 – равновесие сдвинуто вправо;
К <1 – равновесие сдвинуто влево.
Константа равновесия реакции Ксвязана с величиной изменения стандартной энергии Гиббса ΔG для этой же реакции:
ΔG = – RTlnK,или ΔG = ‑2,3RTlgK,или К= 10‑0,435ΔG/RT
Если К >1, то lgK > 0 и ΔG < 0, т. е. если равновесие сдвинуто вправо, то реакция – переход от исходного состояния к равновесному – идет самопроизвольно.
Если К <1, то lgK < 0 и ΔG > 0, т. е. если равновесие сдвинуто влево, то реакция самопроизвольно вправо не идет.
Закон смещения равновесия:если на систему, находящуюся в равновесии, оказывается внешнее воздействие, в системе возникает процесс, который противодействует внешнему воздействию.
5. Окислительно‑восстановительные реакции
Окислительно‑восстановите льные реакции– реакции, которые идут с изменением степеней окисления элементов.
Окисление– процесс отдачи электронов.
Восстановление– процесс присоединения электронов.
Окислитель– атом, молекула или ион, который принимает электроны.
Восстановитель– атом, молекула или ион, который отдает электроны.
Окислители, принимая электроны, переходят в восстановленную форму:
F2 [ок. ] + 2ē → 2F¯ [восст.].
Восстановители, отдавая электроны, переходят в окисленную форму:
Na0[восст. ] – 1ē → Na+[ок.].
Равновесие между окисленной и восстановленной формами характеризуется с помощью уравнения Нернстадля окислительно‑восстановительного потенциала:
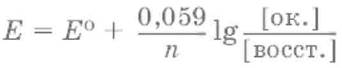
где Е0– стандартное значение окислительно‑восстановительного потенциала; n – число переданных электронов; [восст. ] и [ок. ] – молярные концентрации соединения в восстановленной и окисленной формах соответственно.
Величины стандартных электродных потенциалов Е0приведены в таблицах и характеризуют окислительные и восстановительные свойства соединений: чем поло‑жительнее величина Е0,тем сильнее окислительные свойства, и чем отрицательнее значение Е0,тем сильнее восстановительные свойства.
Например, для F2 + 2ē ↔ 2F¯Е0=2,87 вольт, а для Na++ 1ē ↔ Na0Е0=‑2,71 вольт (процесс всегда записывается для реакций восстановления).
Окислительно‑восстановительная реакция представляет собой совокупность двух полуреакций, окисления и восстановления, и характеризуется электродвижущей силой (э.д.с.) ΔЕ0:ΔЕ0= ΔЕ0ок – ΔЕ0восст, где Е0оки ΔЕ0восст– стандартные потенциалы окислителя и восстановителя для данной реакции.
Э.д.с. реакции ΔЕ0связана с изменением свободной энергии Гиббса ΔG и константой равновесия реакции К:
ΔG = – nFΔЕ0или ΔЕ = (RT/nF)lnK.
Э.д.с. реакции при нестандартных концентрациях ΔЕравна: ΔЕ =ΔЕ0– (RT/nF) × IgKили ΔЕ =ΔЕ0–(0,059/n)lgK.
В случае равновесия ΔG = 0 и ΔЕ = 0, откуда ΔЕ =(0,059/n)lgK и К =10nΔE/0,059.
Для самопроизвольного протекания реакции должны выполняться соотношения: ΔG < 0 или К >>1, которым соответствует условие ΔЕ0> 0. Поэтому для определения возможности протекания данной окислительно‑восстановительной реакции необходимо вычислить значение ΔЕ0.Если ΔЕ0 >0, реакция идет. Если ΔЕ0<0, реакция не идет.
Химические источники тока
Гальванические элементы– устройства, преобразующие энергию химической реакции в электрическую энергию.
Гальванический элемент Даниэлясостоит из цинкового и медного электродов, погруженных в растворы ZnSO4 и CuSO4 соответственно. Растворы электролитов сообщаются через пористую перегородку. При этом на цинковом электроде идет окисление: Zn → Zn2++ 2ē, а на медном электроде – восстановление: Cu2++ 2ē → Cu. В целом идет реакция: Zn + CuSO4 = ZnSO4 + Cu.
Анод– электрод, на котором идет окисление. Катод – электрод, на котором идет восстановление. В гальванических элементах анод заряжен отрицательно, а катод – положительно. На схемах элементов металл и раствор отделены вертикальной чертой, а два раствора – двойной вертикальной чертой.
Так, для реакции Zn + CuSO4 = ZnSO4 + Cu схемой гальванического элемента является запись: (‑)Zn | ZnSO4 || CuSO4 | Cu(+).
Электродвижущая сила (э.д.с.) реакции равна ΔЕ0= Е0ок – Е0восст= Е0(Cu2+/Cu) – Е0(Zn2+/Zn) = 0,34 – (‑0,76) = 1,10 В. Из‑за потерь напряжение, создаваемое элементом, будет несколько меньше, чем ΔЕ0.Если концентрации растворов отличаются от стандартных, равных 1 моль/л, то Е0ок и Е0восст вычисляются по уравнению Нернста, а затем вычисляется э.д.с. соответствующего гальванического элемента.
Сухой элементсостоит их цинкового корпуса, пасты NH4Cl с крахмалом или мукой, смеси MnO2 с графитом и графитового электрода. В ходе его работы идет реакция: Zn + 2NH4Cl + 2MnO2 = [Zn(NH3)2]Cl + 2MnOOH.
Схема элемента: (‑)Zn | NH4Cl | MnO2, C(+). Э.д.с. элемента – 1,5 В.
Аккумуляторы.Свинцовый аккумулятор представляет собой две свинцовые пластины, погруженные в 30%‑ный раствор серной кислоты и покрытые слоем нерастворимого PbSO4. При заряде аккумулятора на электродах идут процессы:
PbSO4(тв) + 2ē → Рb(тв) + SO42‑
PbSO4(тв) + 2H2O → РbO2(тв) + 4H++ SO42‑+ 2ē
При разряде аккумулятора на электродах идут процессы:
РЬ(тв) + SO42‑ → PbSO4(тв) + 2ē
РbO2(тв) + 4H++ SO42‑+ 2ē → PbSO4(тв) + 2Н2O
Суммарную реакцию можно записать в виде:
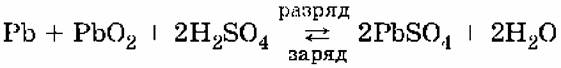
Для работы аккумулятор нуждается в регулярной зарядке и контроле концентрации серной кислоты, которая может несколько уменьшаться при работе аккумулятора.
Растворы
Концентрация растворов
Массовая доля вещества в растворе wравна отношению массы растворенного вещества к массе раствора: w = mв‑ва/mр‑раили w = mв‑вa/(V × ρ), так как mр‑ра = Vp‑pa × ρр‑ра.
Молярная концентрация сравна отношению числа молей растворенного вещества к объему раствора: с = n(моль)/V(л) или с = m/(М × V(л)).
Молярная концентрация эквивалентов (нормальная или эквивалентная концентрация) сэравна отношению числа эквивалентов растворенного вещества к объему раствора: сэ = n(моль экв.)/V(л) или сэ = m/(Мэ × V(л)).
Буферные растворы
Буферные растворы – растворы, имеющие определенную концентрацию ионов водорода. рН этих растворов не меняется при разбавлении и мало меняется при добавлении небольших количеств кислот и щелочей.
I. Раствор слабой кислоты НА, концентрация – скисл, и ее соли с сильным основанием ВА, концентрация – ссоли. Например, ацетатный буфер – раствор уксусной кислоты и ацетата натрия: CH3COOH + CHgCOONa.
рН = рКкисл + lg(ссоли/скисл).
II. Раствор слабого основания ВOH, концентрация – сосн, и его соли с сильной кислотой ВА, концентрация – ссоли. Например, аммиачный буфер – раствор гидроксида аммония и хлорида аммония NH4OH + NH4Cl.
рН = 14 – рКосн – lg(ссоли/сосн).
Гидролиз солей
Гидролиз солей – взаимодействие ионов соли с водой с образованием слабого электролита.
Примеры уравнений реакций гидролиза.
I. Соль образована сильным основанием и слабой кислотой:
Na2CO3 + H2O ↔ NaHCO3 + NaOH
2Na++ CO32‑+ H2O ↔ 2Na++ HCO3¯ + OH¯
CO32‑+ H2O ↔ HCO3¯ + OH¯, pH > 7, щелочная среда.
По второй ступени гидролиз практически не идет.
II. Соль образована слабым основанием и сильной кислотой:
AlCl3 + H2O ↔ (AlOH)Cl2 + HCl
Al3++ ЗCl¯ + H2O ↔ AlOH2++ 2Cl¯ + Н++ Cl¯
Al3++ H2O ↔ AlOH2++ Н+, рН < 7.
По второй ступени гидролиз идет меньше, а по третьей ступени практически не идет.
III. Соль образована сильным основанием и сильной кислотой:
KNO3 + H2O ≠
К++ NO3¯ + Н2O ≠ нет гидролиза, рН ≈ 7.
IV. Соль образована слабым основанием и слабой кислотой:
CH3COONH4 + H2O ↔ CH3COOH + NH4OH
CH3COO¯ + NH4++ H2O ↔ CH3COOH + NH4OH, рН = 7.
В ряде случаев, когда соль образована очень слабыми основаниями и кислотами, идет полный гидролиз. В таблице растворимости у таких солей символ – «разлагаются водой»:
Al2S3 + 6Н2O = 2Al(OH)3↓ + 3H2S↑
Возможность полного гидролиза следует учитывать в обменных реакциях:
Al2(SO4)3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 3Na2SO4 + 3CO2↑
Степень гидролизаh– отношение концентрации гидролизованных молекул к общей концентрации растворенных молекул.
Для солей, образованных сильным основанием и слабой кислотой:
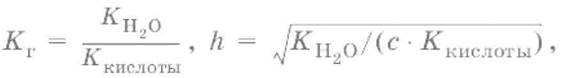
[OH¯] = ch,рOH = – lg[OH¯], рН = 14 – рOH.
Из выражения следует, что степень гидролиза h(т. е. гидролиз) увеличивается:
а) с увеличением температуры, так как увеличивается K(H2O);
б) с уменьшением диссоциации кислоты, образующей соль: чем слабее кислота, тем больше гидролиз;
в) с разбавлением: чем меньше с, тем больше гидролиз.
Для солей, образованных слабым основанием и сильной кислотой
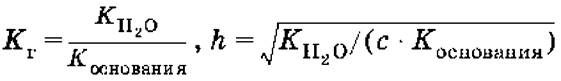
[Н+] = ch,рН = – lg[H+].
Для солей, образованных слабым основанием и слабой кислотой
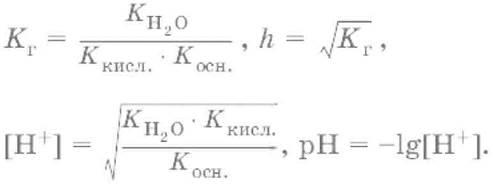
Координационные соединения
Координационные (комплексные) соединения – соединения с донорно‑акцеп‑торной связью.
Для K3[Fe(CN)6]:
ионы внешней сферы – 3К+,
ион внутренней сферы – [Fe(CN)6]3‑,
комплексообразователь – Fe3+,
лиганды – 6CN¯, их дентатность – 1,
координационное число – 6.
Примеры комплексообразователей: Ag+, Cu2+, Hg2+, Zn2+, Ni2+, Fe3+, Pt4+и др.
Примеры лигандов: полярные молекулы Н2O, NH3, CO и анионы CN¯, Cl¯, OH¯ и др.
Координационные числа: обычно 4 или 6, реже 2, 3 и др.
Номенклатура.Называют сначала анион (в именительном падеже), затем катион (в родительном падеже). Названия некоторых лигандов: NH3 – аммин, Н2O – акво, CN¯ – циано, Cl¯ – хлоро, OH¯ – гидроксо. Названия координационных чисел: 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса. Указывают степень окисления комплек‑сообразователя:
[Ag(NH3)2]Cl – хлорид диамминсеребра(I);
[Cu(NH3)4]SO4 – сульфат тетрамминмеди(II);
K3[Fe(CN)6] – гексацианоферрат(III) калия.
Химическаясвязь.
Теория валентных связей предполагает гибридизацию орбиталей центрального атома. Расположение образующихся при этом гибридных орбиталей определяет геометрию комплексов.
Диамагнитный комплексный ион Fe(CN)64‑.
Цианид‑ион – донор
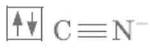
Ион железа Fe2+– акцептор – имеет формулу 3d64s04p0. С учетом диамагнитности комплекса (все электроны спарены) и координационного числа (нужны 6 свободных орбиталей) имеем d2sp3‑гибридизацию:

Комплекс диамагнитный, низкоспиновый, внутриорбитальный, стабильный (не используются внешние электроны), октаэд‑рический (d2sp3‑гибридизация).
Парамагнитный комплексный ион FeF63‑.
Фторид‑ион – донор.
Ион железа Fe3+– акцептор – имеет формулу 3d54s04p0.С учетом парамагнитности комплекса (электроны распарены) и координационного числа (нужны 6 свободных орбиталей) имеем sp3d2‑гибридизацию:
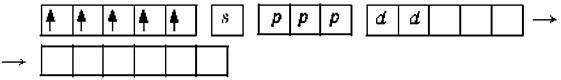
Комплекс парамагнитный, высокоспиновый, внешнеорбитальный, нестабильный (использованы внешние 4d‑орбитали), октаэдрический (sp3d2‑гибридизация).
II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
Оксиды
Оксиды – сложные вещества, состоящие из атомов кислорода в степени окисления ‑2 и атомов другого элемента.
Номенклатура: Fe2O3 – оксид железа(III), Cl2O – оксид хлора(I).
Классификация оксидов
Несолеобразующие (безразличные) оксиды: CO, SiO, NO, N2O.
Солеобразующие оксиды:
основные – оксиды металлов в степени окисления +1, +2,
амфотерные – оксиды металлов в степени окисления +2, +3, +4,
кислотные – оксиды металлов в степени окисления +5, +6, +7 и
оксиды неметаллов в степени окисления +1 – +7.
Получение оксидов
Горение простых веществ:
С + O2 = CO2
2Са + O2 = 2СаО
Горение (обжиг) сложных веществ:
CH4 + 2O2 = CO2 + 2Н2O
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Разложение сложных веществ:
CaCO3 →t→ СаО + CO2
2Fe(OH)3 →t→ Fe2O3 + ЗН2O
Химические свойства оксидов
Основным оксидам (Na2O, CaO, CuO, FeO) соответствуют основания.
СаО + Н2O = Са(OH)2 (растворимы оксиды металлов IA– и IIА‑групп, кроме Be, Mg)
CuO + Н2O ≠ (оксиды остальных металлов нерастворимы)
СаО + CO2 = CaCO3
СаО + 2HCl = CaCl2 + Н2O
Кислотным оксидам (CO2, Р2O5, СrO3, Mn2O7) соответствуют кислоты.
SO2 + Н2O = H2SO3 (кислотные оксиды, кроме SiO2, растворимы в воде)
SO2 + СаО = CaSO3
SO2 + 2NaOH = Na2SO3 + Н2O
Амфотерным оксидам (ZnO, Al2O3, Cr2O3, ВеО, РЬО) соответствуют амфотерные гидроксиды.
ZnO + H2O ≠ (амфотерные оксиды нерастворимы в воде)
ZnO + 2HCl = ZnCl2 + Н2O
ZnO + 2NaOH →t→ Na2ZnO2 + Н2O (при нагревании или сплавлении)
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] (в разбавленном растворе)
Основания
Основания– сложные вещества, состоящие из атомов металла и гидроксиль‑ных групп; основания – электролиты, образующие при диссоциации в качестве анионов только анионы гидроксила.
Номенклатура: Fe(OH)3 – гидроксид железа(III).
Классификация оснований:
– растворимые (щелочи) NaOH, KOH;
– нерастворимые Fe(OH)2, Mg(OH)2;
– амфотерные Zn(OH)2, Al(OH)3, Ве(OH)2, Сr(OH)3;
– однокислотные NaOH, KOH;
– двухкислотные Ва(OH)2, Zn(OH)2;
– трехкислотные Al(OH)3, Сr(OH)3.
Получение оснований
Получение щелочей:
2Na + 2Н2O = 2NaOH + Н2
Na2O + Н2O = 2NaOH
Получение нерастворимых и амфотер‑ных оснований:
FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl
Свойстващелочей:
NaOH → Na++ OH¯ (α = 1, фенолфталеин – красный)
NaOH + HCl = NaCl + H2O (реакция нейтрализации)
2NaOH + CO2 = Na2CO3 + H2O
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
2NaOH + Al2O3 →t→ 2NaAlO2 + H2O
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2
2NaOH + 2Al + 6H2O = 2Na[Al(OH)4] + 3H2
2NaOH + Si + H2O = Na2SiO3 + 2H2
Свойства нерастворимых оснований:
Fe(OH)2 ↔ FeOH++ OH¯ (α << 1);
FeOH+ ↔ Fe2++ OH‾ (α << 1)
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
Fe(OH)2 →t→ FeO + H2O
Свойства амфотерных оснований:
Al3++ ЗOH¯ + Н2O ↔ Al(OH)3↓ + Н2O ↔ [Al(OH)4]¯ + Н+
Al(OH)3 + ЗHCl = AlCl3 + ЗН2O
Al(OH)3 + NaOH = Na[Al(OH)4]
2Al(OH)3 →t→ Al2O3 + ЗН2O
Кислоты
Кислоты– сложные вещества, состоящие из атомов водорода и кислотного остатка; кислоты – электролиты, образующие при диссоциации в качестве катионов только катионы водорода.
Номенклатура кислот и кислотных остатков:
| Форула | Название | Форула | Название |
| HClO | хлорноватистая | ClO- | гипохлорит |
| HClO2 | хлористая | ClO2- | хлорит |
| HClO3 | хлорноватая | ClO3- | хлорат |
| HClO4 | хлорная | ClO4- | перхлорат |
| HCl | хлороводородная | Cl- | хлорид |
| НF | фтороводо-родная | F- | фторид |
| НВr | бромоводо-родная | Br- | бромид |
| HI | иодоводород-ная | I- | иодид |
| H2S | сероводородная | S2- | сульфид |
| H2SO4 | серная | SO42- | сульфат |
| H2SO3 | сернистая | SO32- | сульфит |
| HNO3 | азотная | NO3- | нитрат |
| HNO2 | азотистая | NO2- | нитрит |
| H3PO4 | фосфорная | PO43- | ортофосфат |
| H2CO3 | угольная | CO32- | карбонат |
| H2SiO3 | кремниевая | SiO32- | силикат |
| CH3COOH | уксусная | CH3COO- | ацетат |
Классификация кислот:
– одноосновные HCl
– двухосновные H2S
– трехосновные Н3PO4
– кислородсодержащие HNO3
– бескислородные HCl
Получение кислот
CO2 + Н2O = Н2CO3 (кроме SiO2)
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
H2 + Cl2 = 2HCl
Химические свойства кислот
HCl → H++ CI¯ (α =1) (лакмус – красный)
CH3COOH ↔ CH3COO¯ + H+(α << 1)
Fe + 2HCl = FeCl2 + H2 (металл в ряду напряжений до Н)
Cu + HCl ≠ (не идет, металл в ряду напряжений после Н)
2HCl + CuO = CuCl2 + Н2O
2HCl + Cu(OH)2 = CuCl2 + 2Н2O
2HCl + ZnO = ZnCl2 + Н2O
3HCl + Al(OH)3 = AlCl3 + 3Н2O
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑ (выделяется газ)
HCl + AgNO3 = AgCl↓ + HNO3 (образуется осадок)
Соли
Соли – сложные вещества, состоящие из атомов металла и кислотного остатка.
Соли – электролиты, образующие при диссоциации катионы металла или аммония и анионы кислотного остатка.
Номенклатура солей
Na2HPO4 – гидрофосфат натрия
Са(Н2PO4)2 – дигидрофосфат кальция
AlOHSO4 – гидроксид сульфат алюминия
KMgF3 – фторид калия магния
NaCl • NaF – фторид хлорид натрия
NaNH4HPO4 – гидрофосфат аммония натрия
Na2[Zn(OH)4] – тетрагидроксоцинкат натрия
Классификация солей
– средние – MgCl2, Na3PO4
– кислые – Na2HPO4, Ca(H2PO4)2
– основные – MgOHCl, (Al(OH)2)2SO4
– смешанные – NaCl • NaF, CaBrCl
– двойные – KMgF3, KAl(SO4)2
– комплексные – Na2[Zn(OH)4], K3[Cr(OH)6]
– кристаллогидраты – CuSO4 • 5H2O
Получение солей (на примере получения CuS04)
Cu + 2H2SO4 конц = CuSO4 + SO2 + 2H2O
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
CuO + H2SO4 = CuSO4 + H2O
CuO + SO3 = CuSO4
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
CuCO3 + H2SO4 = CuSO4 + H2O + CO2
CuCl2 + Ag2SO4 = CuSO4 + 2AgCl↓
Химические свойства солей
NaHCO3 → Na++ HCO3¯ (α = 1)
HCO3¯ ↔ H++ CO32‑(α << 1)
MgOHCl → MgOH++ CI¯ (α = 1)
MgOH+ ↔ Mg2++ OH¯ (α << 1)
NaHSO4 → Na++ Н++ SO4¯ (α = 1)
CuSO4 + Fe = Cu + FeSO4 (Fe до Cu в ряду напряжений)
Pb + ZnCl2 ≠ (Pb после Zn в ряду напряжений)
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4(осадок)
CuSO4 + H2S = CuS↓ + H2SO4 (осадок)
CuSO4 + BaCl2 = BaSO4↓ + CuCl2 (осадок)
III. Аналитическая химия
Количественный анализ
Метод нейтрализации
Уравнение реакции:Н++ OH¯ → Н2O или Н3O++ OH¯ → 2Н2O.
Основные титранты (рабочие растворы):растворы сильных кислот (HCl или H2SO4) и сильных оснований (NaOH или KOH).
Установочные вещества (или первичные стандарты):тетраборат натрия Na2B4O7 × 10 Н2O, карбонат натрия Na2CO3, щавелевая кислота Н2С2O4 • 2Н2O, янтарная кислота Н2С4Н4O4.
Индикаторы:кислотно‑основные индикаторы (см. таблицу).
Характеристики некоторых индикаторов приведены в таблице.


Некоторые примеры кислотно‑основного титрования
Титрование сильно
