Общая характеристика элементов VА группы периодической системы элементов. Фосфор и его соединения.
V группу периодической системы составляют азот, фосфор, мышьяк, сурьма и висмут. Каждый из элементов имеет электронную конфигурацию на внешнем уровне пs2пр2 и может проявлять в своих соединениях степень окисления от -3 до +5. Азот и фосфор — типичные неметаллы, мышьяк проявляет и металлические свойства, сурьма и висмут — типичные металлы. В отличие от всех других, в V группе периодической системы очень резко изменяются свойства составляющих ее элементов.
Фосфор — известен его единственный стабильный изотоп 31Р. Фосфор, как и азот, тоже является одним из незаменимых для жизни элементов и входит в состав всех живых организмов. Он содержится в костных тканях и необходим животным в процессах обмена веществ для накопления энергии.
Фосфор реагирует с металлами, образуя фосфиды; последние, взаимодействуя с водой или кислотами, выделяют фосфин РН3:
6Mg + Р4 = 2Мg3Р2; Мg3Р2 + 6Н2О = 3Мg(ОН)2 + 2PH3↑;
Получение фосфора. Белый фосфор получают восстановлением фосфата кальция в электрической печи без доступа воздуха и в присутствии SiO2, который вводят для связывания СаО в легкоплавкий шлак: Са3(РО4)2 + 3SiO2 + 5С = 2Р + 5CO↑ + 3CaSiO3.
Фосфор образует два хлорида: трихлорид фосфора РСl3 и пентахлорид фосфора РCl5.
Трихлорид фосфора получают, пропуская хлор над поверхностью белого фосфора Р4 + 6 Сl2 = 4РС13, при этом фосфор горит бледно-зеленым пламенем, а образующийся хлорид фосфора конденсируется в виде бесцветной жидкости.
Трихлорид фосфора гидролизуется водой с образованием фосфористой кислоты и хлороводорода: РС13 + 3Н2О = Н3РО3 + 3HCl.
Пентахлорид фосфора можно получить в лабораторных условиях либо по реакции Р4 + 10Сl2 = 4PCl5, либо с помощью реакции хлора и трихлорида фосфора, проводимой при температуре около О °С. Эта реакция обратима: РС13 + Cl2 = РСl5 .
Пентахлорид фосфора бурно реагирует с водой, образуя фосфорную кислоту: РС15 + 4Н2О = Н3РО4 + 5HCI.
Фосфорные кислоты. Из трех фосфорных кислот наибольшее практическое значение имеет ортофосфориая кислота Н3РО4 (часто ее называют просто фосфорной) — белое твердое вещество, хорошо растворимое в воде. В водном растворе она диссоциирует ступенчато. Как трехосновная, фосфорная кислота образует три типа солей: дигидрофосфаты (NaH2PO4); гидрофосфаты (Na2HPO4); фосфаты (Na3PO4). Все дигидрофосфаты растворимы в воде.
115. Общая характеристика элементов VII А группы периодической системы элементов. Хлор и его соединения.
Элементы фтор, хлор, бром, иод и астат составляют VII А-группу—группу галогенов. Все элементы обладают электронной конфигурацией ns2nр5, т.е. для образования конфигурации инертного газа им недостает одного электрона. Это обусловливает характерную степень окисления всех элементов -1. Фтор - наиболее электроотрицательный элемент периодической системы, он не образует соединений, в которых проявлялась бы положительная степень окисления. В то же время для хлора, брома, и иода известны степени окисления +1, +3, +5 и +7. При обычных условиях галогены существуют в виде простых веществ, состоящих из двухатомных молекул типа Hal2. Физические свойства галогенов существенно различаются: при нормальных условиях фтор — бледно-желтый, трудносжижаемый газ; хлор — также газ желто-зеленого цвета, но сжижается легко; бром — красно-коричневая густая жидкость с тяжелыми коричневыми парами; иод — блестящие серо-черные кристаллы.
Галогены имеют характерный резкий запах. Все галогены, особенно фтор и хлор — токсичны. Так, например, хлор оказывает сильное раздражающее действие, особенно на глаза и дыхательную систему.
хлор при нормальных условиях — ядовитый газжелтовато-зелёного цвета, тяжелее воздуха, с резким запахом и сладковатым, «металлическим»вкусом. Молекула хлора двухатомная (формула Cl2).
В природе встречаются два изотопа хлора 35Cl и 37Cl. В земной коре хлор самый распространённый галоген. Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов:галита NaCl, сильвина KCl и др.
Взаимодействие с металлами
Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании): 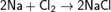 ;
; 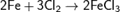
Взаимодействие с неметаллами
C неметаллами (кроме углерода, азота, фтора, кислорода и инертных газов), образует соответствующие хлориды.

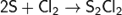
С кислородом хлор образует оксиды (см. статью Оксиды хлора), в которых он проявляет степень окисления от +1 до +7: Cl2O, ClO2, Cl2O5, Cl2O7. Они имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду.
Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли, основные процессы которого можно представить суммарной формулой: 
