Ароматические углеводороды
Это циклические углеводороды с тремя двойными сопряженными связями в цикле.
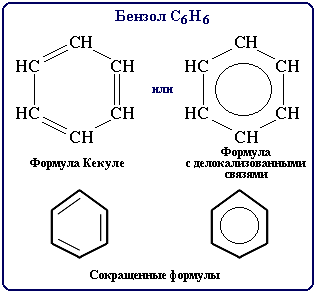 Бензол С6Н6 – родоначальник ароматических углеводородов. Впервые выделен Фарадеем в 1825г из светильного газа.
Бензол С6Н6 – родоначальник ароматических углеводородов. Впервые выделен Фарадеем в 1825г из светильного газа.
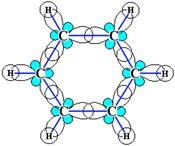
Каждый из шести атомов углерода в его молекуле находится в состоянии sp2-гибридизации и связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы между каждой парой π-связей равны 1200.
Таким образом, скелет σ-связей представляет собой правильный шестиугольник, в котором все атомы углерода и все σ-связи С–С и С–Н лежат в одной плоскости.
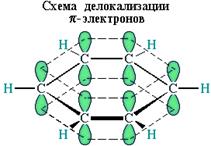
р-Электроны всех атомов углерода образуют единое циклическое π-электронное облако, сосредоточенное над и под плоскостью кольца.
Все связи С–С в бензоле равноценны, их длина равна 0,140 нм, что соответствует промежуточному значению между одинарной и двойной.
Это означает, что в молекуле бензола между углеродными атомами нет чисто простых и двойных связей (как в формуле, предложенной в 1865 г. немецким химиком Ф.Кекуле), а все они выровнены (делокализованы).
Общая формула гомологического ряда бензола CnH2n-6 (n ≥ 6).
| Вещество | Название по номенклатуре | Историческое название |
| С6Н5-СН3 | метилбензол | Толуол |
| С6Н5-СН2-СН3 | этилбензол | --- |
| СН3-С6Н4-СН3 | диметилбензол | ксилол |
| С6Н5-СН(СН3)2 | изопропилбензол | кумол |
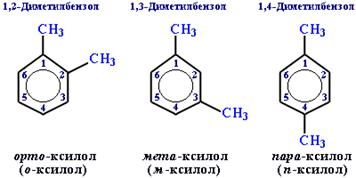 Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Кольцо нумерют так, чтобы номера радикалов были наименьшими.
Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Кольцо нумерют так, чтобы номера радикалов были наименьшими.
Для дизамещенных бензолов
R-C6H4-R'
используется также другой способ построения названий:
орто- (о-) заместители у соседних атомов углерода кольца, 1,2-;
мета- (м-) заместители через один атом углерода (1,3-);
пара-(п-) заместители на противоположных сторонах кольца(1,4-).
Изомерия у аренов.
Определяется числом заместителей, их расположением в бензольном кольце и возможностью изомерии углеродного скелета в заместителях, содержащих более трёх атомов углерода.
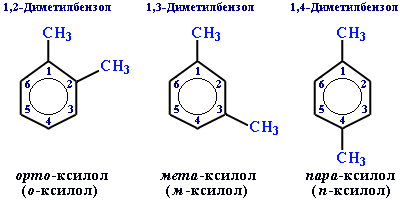 Для ароматического углеводорода С8Н10 существуют 4 изомера: орто-, мета- и пара-ксилолы и этилбензол.
Для ароматического углеводорода С8Н10 существуют 4 изомера: орто-, мета- и пара-ксилолы и этилбензол.
ПОЛУЧЕНИЕ АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ
Дегидрирование циклоалканов
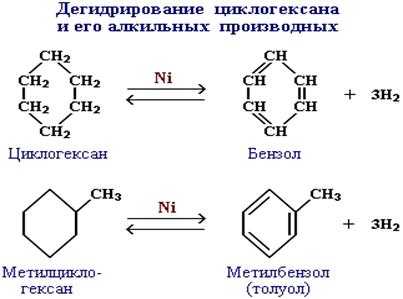
2. Дегидроциклизация (дегидрирование и циклизация) алканов в присутствии катализатора
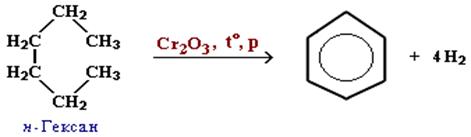
3.Тримеризация ацетилена над активированным углем (реакция Зелинского):
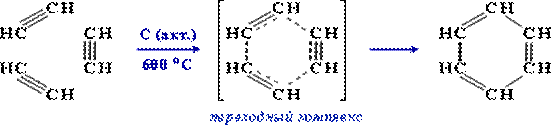
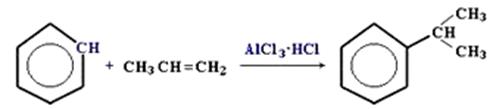
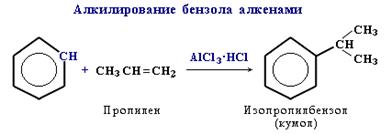
4.Алкилирование бензола галогеналканами в присутствии безводного хлорида алюминия или алкенами:
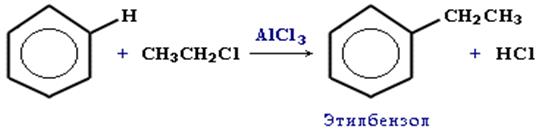
ФИЗИЧЕСКИЕ СВОЙСТВА.
Бензол и его ближайшие гомологи – бесцветные жидкости с характерным запахом, с плотностью менее 1 г/мл. Огнеопасны. Нерастворимы в воде, но хорошо растворимы в неполярных растворителях. Бензол и толуол ядовиты (поражают почки, печень, костный мозг, кровь).
Высшие арены – твердые вещества.
ХИМИЧЕСКИЕ СВОЙСТВА.
Из-за наличия делокализованой -системы арены мало характерны реакции присоединения или окисления, которые ведут к нарушению ароматичности. Для них наиболее характерны реакции электрофильного замещенияатомов водорода, связанных с циклом- SЕ.
1. РЕАКЦИИ ПРИСОЕДИНЕНИЯ К АРЕНАМ
В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, арены могут вступать с большим трудом.
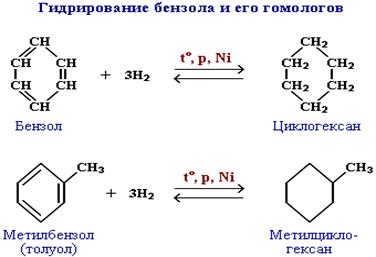
а. Гидрирование. Присоединение водорода к бензолу и его гомологам происходит при повышенной температуре и давлении в присутствии металлических катализаторов.
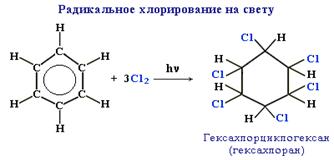
б. Радикальное хлорирование. При радикальном хлорировании бензола получается гексахлорциклогексан - "гексахлоран" (средство борьбы с вредными насекомыми).
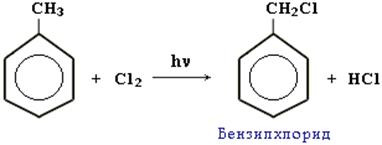
2. РЕАКЦИИ РАДИКАЛЬНОГО ЗАМЕЩЕНИЯ АТОМОВ ВОДОРОДА В БОКОВОЙ ЦЕПИ:
В случае гомологов бензола при действии хлора на свету или при нагревании происходит реакция радикального замещения в боковой цепи:
3. Реакции окисления аренов
Бензол не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т.п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений.
В отличие от бензола его гомологи окисляются довольно легко. При действии раствора KMnO4 в кислой среде и нагревании в гомологах бензола окислению подвергаются только боковые цепи, при этом от боковой цепи остаётся карбоксильная группа, а остальное – переходит в углекислый газ:
5С6Н5-СН3 +6КМnO4+9H2SO4 à5C6H5-COOH+6MnSO4+3K2SO4+14H2O
5С6Н5-CH2-CH3 +12КМnO4+18H2SO4à5C6H5-COOH+5СО2+12MnSO4+
+6K2SO4+28H2O
Если окисление идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты и карбонат калия:
С6Н5-СН2-СН3+4KMnO4àC6H5 – COOK+K2CO3+4MnO2+KOH+2H2O
4.РЕАКЦИИ ЗАМЕЩЕНИЯ В БЕНЗОЛЬНОМ КОЛЬЦЕ
Галогенирование
Замещение атома водорода в бензольном кольце на галоген происходит в присутствии катализаторов AlCl3, AlBr3, FeCl3 и т.п.:
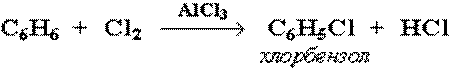
Нитрование
Бензол реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
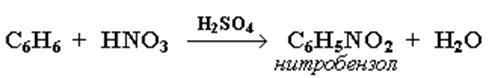
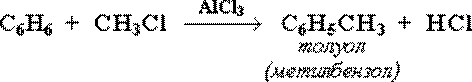
Алкилирование
Замещение атома водорода в бензольном кольце на алкильную группу(алкилирование) происходит под действием алкилгалогенидов в присутствии катализаторов AlCl3, FeBr3или алкенов в присутствии фосфорной кислоты:
ЗАМЕЩЕНИЕ В АЛКИЛБЕНЗОЛАХ
Гомологи бензола (алкилбензолы) более активно вступают в реакции замещения по сравнению с бензолом. Например, при нитровании толуола С6Н5-CH3 может происходить замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола, причём в орто- и пара- положениях:

