Каскадный эффект эндокринной регуляции
Принцип действия системы эндокринной регуляции во многих случаях приводит к появлению так называемого каскадного эффекта: единичные молекулы гормонов, выделяемых на высшем уровне регуляторной пирамиды, приводят к выбросу значительных количеств молекул гормонов периферическими звеньями. Если же результатом действия всей управленческой вертикали должно стать выделение в кровь какого-либо вещества (например, глюкозы), то эффективность каскада проявляется еще более наглядно, рассмотрим каскадный эффект на примере управления отложением гликогена в клетках печени. Гипоталамус выделяет ничтожное количество кортиколиберина, в ответ на который аденогипофиз выбрасывает в кровь в 10 раз большее количество АКТГ. Достигнув коры надпочечников, этот гормон стимулирует выработку кортикостероидов в значительно больших количествах, а на внутриклеточном этапе метаболической регуляции коэффициент усиления достигает колоссальных размеров (табл. 14). Существование каскадного эффекта делает механизмы эндокринной регуляции во многих случаях весьма эффективными.
Таблица 14
Каскадный эффект эндокринной регуляции синтеза гликогена в печени
| Орган | Синтезируемое вещество | Количество вещества, мкг |
| Гипоталамус | Кортиколиберин | 0,1 |
| Аденогипофиз | Кортикотропин (АКТГ) | |
| Кора надпочечников | Кортикостероид | |
| Печень | Гликоген |
Важнейшие железы внутренней секреции
Познакомимся с устройством и функцией важнейших желез внутренней секреции и ролью их гормонов в организме человека (рис.71).
Гипофиз — небольшой овальный непарный орган, расположенный у основания мозга в углублении турецкого седла основания черепа. Масса гипофиза у новорожденного составляет 0,1—0,15 г, к возрасту 10 лет она удваивается, а у взрослых превышает 0,5 г. Гипофиз состоит как бы из трех разных желез, различающихся Морфологически и по характеру продуцируемых гормонов. Согласно Международной анатомической номенклатуре, переднюю долю гипофиза называют аденогипофизом, а заднюю — нейрогипофизом.
Передняя доля гипофиза (аденогипофиз) чувствительна к гипоталамическим рилизинг-факторам. Здесь вырабатываются тропныее гормоны: тиреотропный — регулирующий активность щитовидной железы; адренокортикотропный (АКТГ) — управляющий корковым слоем надпочечников; гонадотропные (фолликулости
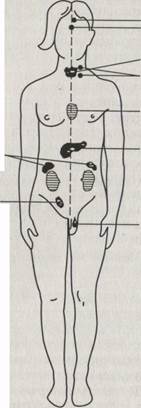 |
Шишковидная железа (эпифиз) Гипофиз
Щитовидная железа
Околощитовидная железа
Вилочковая железа
| Надпочечники |
| Яичники (у девочек) |
| Семенникиики (у мальчиков) |
Поджелудочная железа
Рис. 71. Схема расположения эндокринных желез
мулирующий и лютеинизирующий) — определяющие активность половых желез. Здесь же, в передней доле гипофиза, вырабатываются два гормона прямого действия: гормон роста (соматотропин), регулирующий процессы роста костей в длину и процессы накопления жировой и мышечной массы, и пролактин, оказывающий стимулирующее воздействие на молочные железы и на гонады.
Физиологическое значение гормона роста будет обсуждено позже. Что касается пролактина, то основной мишенью для этого гормона служат млечные железы. Благодаря пролактину осуществляется выработка молока женскими молочными железами после родов. Механическое раздражение сосков кормящей женшины передается через многоступенчатую цепочку нервных волокон в гипоталамус, который выделяет пролактин-рилизинг-факторьь стимулирующие секрецию гормона гипофизом. Интересно, что в большинстве тканей человека обнаружены рецепторы пролактина, однако для чего они и как на эти органы действует данный гормон пока не известно.
есть еще маленькая промежуточная доля гипофиза, которая вырабатывает гормон меланотропин,
от него зависит окраска кожного покрова. Как известно, цвет кожи определяется содержанием и расположением в кожных клетках пигмента меланина. Под влиянием меланотропина зернышки пигмента распределяются по сему объему кожных клеток, в результате чего кожа такого участка приобретает смуглый оттенок. Так называемые пигментные пятна беременности и усиленная пигментация кожи стариков — признаки гиперфункции промежуточной доли гипофиза.
Задняя доля гипофиза работает как периферическая железа (хотя и под контролем гипоталамуса) и секретирует два гормона, которые являются гормонами прямого действия. Это окситоцин и ва-зопрессин (другое название — антидиуретический гормон, или АДГ). Функция окситоцина сравнительно проста: он стимулирует гладкую мускулатуру матки при родах и выделение молока из молочных желез у женщин. Роль, которую играет этот гормон у мужчин, не выяснена.
Вазопрессин (он же АДГ) участвует в регуляции выделительной функции: под его влиянием усиливается обратное всасывание воды из первичной мочи. При патологическом уменьшении количества АДГ в крови возникает так называемый несахарный диабет, человек теряет огромное количество воды (10—20 л), что может привести к обезвоживанию организма. Вместе с гормонами коры надпочечников АДГ участвует в регуляции солевого состава крови, т.е. обеспечивает водно-солевой гомеостаз организма.
Надпочечники — парный конусовидный орган, располагающийся над почками на небольших жировых подушках. Масса каждого надпочечника у новорожденного составляет 2,5—3 г, у взрослого человека — 6—7 г. Каждый надпочечник представляет собой Две совершенно различные железы, неодинаковые по строению и Функции. Как на продольном, так и на поперечном срезе надпочечника отчетливо выделяются два слоя — корковый (наружный) и мозговой (внутренний).
Мозговое вещество надпочечников вырабатывает адреналин и норадреналин — вещества из группы катехоламинов, управляющие тонусом кровеносных сосудов и мобилизацией углеводов. Эти гормоны относятся к разряду быстродействующих, почти мгновенно реагирующих на острый запрос со стороны нервной системы. Такая быстрая реакция возможна потому, что синтезированные заранее молекулы гормонов хранятся в мозговом слое надпочечников в виде гранул, которые легко освобождаются и выводятся в венозный кровоток при первой же потребности. Адреналин ускоряет и усиливает сокращения сердца, учащает дыхание, расширяет бронхи, стимулирует распад гликогена и выход глюкозы кровь из печени, усиливает сокращения скелетной мускулатуры кратковременно снимает их утомление, и т. п. Норадреналин кроме того, резко активирует теплопродукцию в мышцах, печени, жировой ткани. Все эти физиологические эффекты направлены на одно: обеспечить организму немедленную мобилизацию всех ресурсов для осуществления интенсивной мышечной деятельности и терморегуляции. Такая потребность возникает у организма в условиях острого стресса, в экстремальных ситуациях, в условиях резкого переохлаждения. Мозговое вещество надпочечников построено из клеток, тесно связанных происхождением и регуляцией с симпатической нервной системой. Поэтому во всех случаях когда обстоятельства требуют от человека экстренной мобилизации, резко активируется синтез адреналина, а накопленный заранее гормон выбрасывается в кровяное русло.
Корковое вещество надпочечников вырабатывает около 40 различных стероидных гормонов, которые обобщенно называют кортикостероидами. Они подразделяются на три группы:
1. Глюкокортикоиды — гормоны, регулирующие обмен углеводов. К ним относятся гидрокортизон, кортизон и кортикостерон. Еще эти гормоны иногда называют противовоспалительными, поскольку они подавляют образование иммунных тел и снижают повышенную чувствительность организма к некоторым веществам.
2. Минералокортикоиды регулируют минеральный и водный обмен. Одним из гормонов этой группы является альдостерон.
3. Андрогены и эстрогены — аналоги мужских и женских половых гормонов. Эти гормоны вырабатываются в надпочечниках в сравнительно небольших количествах и менее активны, чем гормоны собственно половых желез.
Работа коркового слоя надпочечников управляется гормоном АКТГ, вырабатываемым передним отделом гипофиза. Система гипоталамус—гипофиз—кора надпочечников играет решающую роль в процессах долговременной адаптации организма к любым факторам внешней среды.
Щитовидная железа расположена впереди гортани в виде пары долей, каждая из которых имеет листообразную форму, а вместе они срослись в верхней части в форме перешейка. Масса щитовидной железы новорожденного составляет 1 г, к 10 годам увеличивается примерно до 10 г, а у взрослого достигает 15—18 г. Гормон щитовидной железы тироксин представляет собой соединение йода с аминокислотами. Тироксин — мощный стимулятор обменных процессов в организме. Под его влиянием значительно ускоряется обмен белков, жиров, углеводов, активируется митохондриальное окисление, что приводит к возрастанию потребления кислорода. Благодаря этим свойствам тироксин стимулирует ЦНС. Недостаток гормона способен привести к тяжелым расстройствам
психики, вплоть до резкого отставания в умственном и психическом развитии (кретинизм). Обычно это сочетается со столь же значительным отставанием физического развития и полового созревания. Раннее выявление гипофункции щитовидной железы и адекватное лечение производят значительный эффект.
Увеличение щитовидной железы может быть признаком недостатка йода в рационе (так называемый зоб).Причина может заключаться в недостатке йода в пище и воде (эндемический зоб —болезнь, типичная для жителей некоторых районов, особенно
горных) — тогда йод вводят дополнительно в поваренную соль или рекомендуют активное употребление морских водорослей, богатых йодом. В последние десятилетия большое количество нарушений функции щитовидной железы выявлены в связи с ухудшением экологической, в том числе радиационной обстановки.В зонах, подвергшихся воздействию чернобыльского следа, а так
же в некоторых районах Урала и Поволжья большое число детей, особенно в период полового созревания, страдает от гипофункции щитовидной железы радиогенной природы. Своевременное
лечение, в том числе экзогенными гормонами, а также массированное введение йодистого калия во многих случаях помогает при этом заболевании.
Тироксиновая активность щитовидной железы контролируется тиреотропным гормоном передней доли гипофиза. В свою очередь, повышенное содержание в крови тироксина оказывает тормозящее действие на секреторные клетки аденогипофиза, и уровень тиреотропного гормона тем самым снижается. Так замыкается один из контуров обратной связи, обеспечивающей саморегуляцию активности эндокринной системы.
Наряду с тироксином, щитовидная железа вырабатывает также Другой гормон, обеспечивающий усвоение кальция костной тканью, — калъцитонин. Роль этого гормона особенно велика в период онтогенеза, что связано с усиленным ростом скелета. К старости активность щитовидной железы по производству кальцитонина снижается, и это является одним из факторов повышения хрупкости костей у стариков. Синтез кальцитонина не регулируется гипоталамо-гипофизарной системой, а зависит только от соотношения концентраций кальцитонина и ионов кальция в крови, а также от активности околощитовидных желез.
Околощитовидные, или паращитовидные, железы. Обычно их бывает 4 и расположены они латерально, непосредственно соприкасаясь со щитовидной железой. Это маленькие (около 0,13 г у взрослого) округлые образования. Вырабатываемый этими железами секрет содержит противоположный по своей физиологической роли кальцитонину паратгормон — под его воздействием содержание кальция в крови возрастает. Кальций не только составляет минеральную основу кости, он также совершенно необходим мышцам для нормального сокращения и расслабления. Его недостаток в крови приводит к судорогам. Баланс активности синтеза
кальцитонина щитовидной железой и паратгормона околощитовидными железами — важнейшее условие нормального обмена кальция в организме и поддержания на требуемом уровне мине
рального состава костей.
Поджелудочная железа имеет продолговатую форму и расположена на задней брюшной стенке позади желудка в непосредственной близости от двенадцатиперстной кишки, куда открываются ее протоки для выведения в кишечник пищеварительных ферментов, синтезируемых железой. Масса железы у новорожденного составляет 2—3 г, к подростковому возрасту она увеличивается примерно в 10 раз, а у взрослого достигает 80—100 г. Микроскопическое исследование показывает, что ткань поджелудочной железы состоит из клеток двух типов — экзокринных ацинозных, вырабатывающих пищеварительные ферменты, поступающие в двенадцатиперстную кишку, и трех видов эндокринных клеток островков Лангерганса, вырабатывающих гормоны глюкагон (клетки типа альфа, 25 %), инсулин (клетки типа бета, 60 %) и соматостатин (клетки типа дельта, 15%). Доля эндокринных клеток у новорожденного составляет примерно 3,5 % от общей массы железы, у взрослого даже еще меньше.
Инсулин (от лат. Insula — островок) — это крупная белковая молекула, в состав которой входит свыше 50 аминокислот. Инсулин, вырабатываемый поджелудочной железой разных животных, имеет одинаковое биологическое действие, которое заключается в снижении содержания углеводов в крови за счет их активного поглощения всеми клетками тела, особенно печенью и мышцами, где из глюкозы синтезируется гликоген. Глюкоза — важнейший субстрат для питания нервной ткани, поэтому поддержание уровня глюкозы в крови на постоянном уровне — одна из центральных задач механизмов гомеостаза. После приема пищи содержание сахара в крови резко возрастает, и в ответ увеличивается уровень инсулина. Под его действием молекулы углеводов активно поглощаются печенью и мышцами, в результате содержание глюкозы в крови быстро (в течение примерно 2 ч) нормализуется, а вслед за этим нормализуется и уровень инсулина. В промежутках между приемами пищи уровень инсулина в крови низок, и это позволяет глюкозе свободно выходить из клеток печени, в которых углевод хранится в виде гликогена, и принимать участие в питании мозга и других нуждающихся в пищевых веществах тка ней. Следует отметить, что поглощение глюкозы нервной ткань не зависит от уровня инсулина, зато уровень глюкозы в крови существенно влияет на качество питания мозга. Если глюкозы крови становится меньше 0,5—0,2 г/л, это может привести к погликемическому шоку с помутнением сознания или даже комой.
Такое состояние иногда наблюдается при гиперфункции поджелудочной железы, которая может быть вызвана патологическими процессами (например, опухолью) или нарушением эндокринного баланса в критические периоды развития (у подростков в период полового созревания). Сходные явления бывают также следствием длительной напряженной мышечной нагрузки.
Более известно другое заболевание — сахарный диабет, — связаное с недостаточной секрецией инсулина. В этом случае глюкоза не усваивается клетками тела из-за нехватки в крови гормона, а избыток сахара выделяется с мочой, с чем и связано название этого заболевания. В тяжелых случаях у больных может наступить диабетическая кома. Наряду с диетой важнейшим способом лечения сахарного диабета является регулярное введение экзогенного гормона инсулина, который раньше добывали из поджелудочной железы крупного рогатого скота, а теперь в больших количествах синтезируют химическим путем на фармацевтических фабриках.
Данных о возрастных особенностях секреции инсулина у детей крайне мало. Однако известно, что толерантность (устойчивость) к глюкозной нагрузке у детей до 10 лет выше, а усвоение пищевой глюкозы происходит существенно быстрее, чем у взрослых (это объясняет, почему дети так любят сладкое и потребляют его в больших количествах без опасности для своего здоровья). К старости этот процесс еще больше замедляется, что свидетельствует о снижении инсулярной активности поджелудочной железы. Об этом же говорит и тот факт, что диабет чаще всего развивается у людей после 40 лет, хотя нередки случаи и врожденного диабета, что обычно связано с наследственной предрасположенностью. Такие формы сахарного диабета наиболее трудно поддаются лечению. В период от 6 до 12 лет сахарный диабет иногда развивается на фоне перенесенных острых инфекционных заболеваний (корь, ветряная оспа, свинка). Отмечено, что развитию заболевания способствует переедание, в особенности избыток в пище углеводов.
Глюкагон, вырабатываемый альфа-клетками островков Лангер-ганса, представляет собой полипептид, состоящий из 29 аминокислотных остатков. По своему физиологическому действию глюкагон является антагонистом инсулина: стимулирует расщепление гликогена печени, обеспечивая тем самым быстрое повышение Концентрации глюкозы в крови. Действие глюкагона очень походе на действие адреналина: через аденилаткиназу, образование цАМФ и т.д. Основной орган-мишень для глюкагона — печень, т.е. - главное депо гликогена в организме.
Соматостатин — третий гормон поджелудочной железы — пептид, молекулы которого примерно в 2 раза мельче, чем молекулы глюкогона. Впервые этот гормон был обнаружен в гипоталамусе
он угнетает выработку гипофизом гормона роста, чем и обусловлено его название. В дальнейшем оказалось, что этот пептид вырабатывается во многих тканях организма, причем практически везде он работает как ингибитор. В островках Лангерганса он выступает как внутритканевый гормон, который не поступает в кровь, а действует на местном, периферическом уровне, угнетая секрецию как инсулина, так и глюкагона. Кроме того, он угнетает также работу желудочно-кишечного тракта и всасывание питательных веществ. Секреция соматостатина островковыми дельта-клетками возрастает при высоких концентрациях глюкозы, аминокислот и жирных кислот в крови. Таким образом соматостатин предотвращает перепроизводство инсулина при гипергликемии.
Половые железы у мужчин и женщин сильно различаются. Для эмбрионального развития мужских желез необходимо наличие в генетическом аппарате Y-хромосомы, а для нормального развития женских желез — двух Х-хромосом. Мужские половые гормоны (андрогены) вырабатываются особыми клетками семенников. Женские половые гормоны (эстрогены) продуцируются яичниками. Несмотря на существенное различие в своих физиологических свойствах, как мужские, так и женские половые гормоны относятся к стероидам и синтезируются в организме из одного и того же предшественника — холестерола, важного продукта жирового обмена.
Семенники мужчин — парный орган яйцевидной формы, располагающийся в мошонке вне основной массы тела. Масса обоих семенников новорожденного не превышает 1 г, до возраста 10— 12 лет она остается на уровне 1,5—2 г, с началом полового созревания (13—14 лет) увеличивается до 15 г, а у взрослого мужчины составляет 30—40 г. Кроме семенников, к половым железам у мужчины относится также непарная предстательная железа, которая расположена в тазе, перед прямой кишкой, и окружает шейку мочевого пузыря и уретру. По размеру предстательная железа взрослого мужчины примерно равна одному семеннику.
Женские яичники — это парные органы, расположенные в тазовой полости с каждой из сторон. Масса обоих яичников у новорожденной девочки составляет одну треть грамма, у взрослой женщины — около 10 г.
Мужские половые гормоны — тестостерон и андростерон — обусловливают развитие полового аппарата, рост половых органов, развитие вторичных половых признаков: ломку и огрубение голоса, изменение телосложения, характер роста волос на лице и теле. Вместе с фолликулостимулирующим гормоном гипофиза тестостерон активирует сперматогенез. Главная функция андрогенов в организме — стимуляция синтеза белка. Именно по этой причине мужчины, как правило, крупнее женщин и более мускулистые.
Все анаболики, используемые в медицине и спорте (злоупотребление ими в спорте недопустимо, тогда как при истощении они выполняют роль лекарства), — производные андрогенов, на чем, собственно, и основано их действие. Гиперфункция семенников в раннем возрасте ведет к ускоренному половому созреванию, росту тела и преждевременному появлению вторичных половых признаков. Поражение или удаление (кастрация) семенников в раннем возрасте приводит к недоразвитию половых органов и вторичных половых признаков, а также к отсутствию полового влечения. В норме семенники функционируют в течение всей жизни мужчины. Хотя с возрастом секреция тестостерона снижается, нормальный сперматогенез часто идет до глубокой старости.
Женские половые гормоны — эстрогены — оказывают специфическое влияние на развитие половых органов, выработку яйцеклеток и их подготовку к оплодотворению, влияют на структуру матки и молочных желез. Истинным женским половым гормоном считается эстрадиол. Важную роль в обеспечении нормального протекания беременности играет также прогестерон — гормон, вырабатываемый желтым телом (образованием в яичнике на месте овулировавшей яйцеклетки). Гиперфункция яичников вызывает раннее половое созревание с выраженными вторичными половыми признаками и ранним началом менструаций. В литературе описаны случаи созревания девочек в 4—5 лет, тогда как нормальный возраст наступления половой зрелости у девочек — 12— 15 лет. К старости у женщин наблюдается менопауза (прекращение менструаций), вызванная тем, что все или почти все фолликулы с содержавшимися в них яйцеклетками израсходованы. Секреция эстрадиола при этом прекращается. В результате начинают проявлять себя андрогены, секретируемые надпочечниками, что ведет к некоторым характерным изменениям во внешнем облике женщин после менопаузы. Несмотря на затухание секретирующей функции яичников, гипоталамус и гипофиз продолжают ритмично вырабатывать свои гормоны, нацеленные на половую сферу пожилой женщины. Это ведет к неприятным ощущениям («приливы»). Эти симптомы могут быть ослаблены за счет небольших доз эстрогенов, которые, хотя и обладают некоторым анаболическим действием, все же в этот период могут принести значительную пользу, в том числе и в профилактике остеопороза (вымывания кальция из костей, в результате чего они становятся ломкими).
Половые гормоны в течение всей жизни оказывают сильнейшее влияние на обменные процессы, форму тела, характер жироотложения и поведение человека. Уже у плода мужского пола головной мозг приобретает специфические мужские черты под влиянием андрогенов. Если по той или иной причине воздействия андрогенов на мозг эмбриона не происходит, то он остается феминизированным. Половые гормоны действуют на гипоталамус и лимбическую структуру ЦНС, ответственную за агрессивное половое поведение. При этом между выраженностью вторичных половых признаков у мужчин, активностью их полового поведения и агрессивностью установлена прямая связь.
Гормональный статус новорожденного
Хотя большинство желез внутренней секреции начинает функционировать еще внутриутробно, первым серьезным испытанием для всей системы биологической регуляции организма является момент родов. Родовой стресс — важный пусковой механизм для многочисленных процессов адаптации организма к новым для него условиям существования. Любые нарушения и отклонения в работе регуляторных нейроэндокринных систем, происшедшие в процессе рождения ребенка, могут оказывать серьезное влияние на состояние его здоровья в течение всей последующей жизни.
Первая — срочная — реакция нейроэндокринной системы плода в момент родов направлена на активизацию метаболизма и внешнего дыхания, которое внутриутробно вообще не функционировало. Первый вздох ребенка — важнейший критерий живорожденности, но сам по себе он является следствием сложнейших нервных, гормональных и метаболических воздействий. В пуповинной крови отмечается очень высокая концентрация катехоламинов — адреналина и норадреналина, гормонов «срочной» адаптации. Они не только стимулируют энергетический обмен и распад в клетках жиров и полисахаридов, но и тормозят образование слизи в ткани легких, а также стимулируют дыхательный центр, расположенный в стволовом отделе головного мозга. В первые часы после рождения быстро нарастает активность щитовидной железы, гормоны которой также стимулируют обменные процессы. Все эти гормональные выбросы осуществляются под контролем гипофиза и гипоталамуса. Дети, появившиеся на свет при помощи кесарева сечения и поэтому не испытавшие естественного родового стресса, имеют значительно более низкий уровень катехоламинов и тиреоидных гормонов в крови, что отрицательно сказывается на функции их легких в течение первых суток жизни. В результате их головной мозг страдает от некоторого недостатка кислорода, и это может в какой-то мере сказаться в последствии.
Гормональная регуляция роста
Гипоталамус выделяет два противоположно действующих гормона — рилизинг-фактор и соматостатин, которые направляются в аденогипофиз и регулируют выработку и выделение гормона роста. До сих пор неизвестно, что сильнее стимулирует выброс гормона роста из гипофиза — увеличение концентрации ризинг –фактора или уменьшение содержания соматостатина. Гормона роста секретируется не равномерно, а эпизодически, 3—4 раза в течение дня. Усиление секреции гормона роста происходит под влиянием голодания, тяжелой мышечной работы, а также во время глубокого сна: недаром, видимо, народная традиция утверждает, что дети растут по ночам. С возрастом секреция гормона роста уменьшается, но тем не менее не прекращается в течение всей жизни. Ведь у взрослого человека процессы роста продолжаются, только они уже не приводят к нарастанию массы и числа клеток, а обеспечивают замену устаревших, отработавших клеток новыми.
Выделяющийся гипофизом гормон роста производит два различных воздействия на клетки организма. Первое — непосредственное — действие состоит в том, что в клетках усиливается распад накопленных ранее запасов углеводов и жиров, их мобилизация для нужд энергетического и пластического обмена. Второе — опосредованное — действие осуществляется с участием печени. В ее клетках под воздействием гормона роста вырабатываются вещества-посредники — соматомедины, которые уже воздействуют на все клетки тела. Под влиянием соматомединов усиливается рост костей, синтез белка и деление клеток, т.е. происходят те самые процессы, которые принято называть «ростом». При этом в процессах синтеза белка и клеточного деления принимают участие молекулы жирных кислот и углеводов, высвободившиеся благодаря непосредственному действию гормона роста.
Если выработка гормона роста снижена, то ребенок не вырастает и становится карликом. При этом он сохраняет нормальное телосложение. Рост может также преждевременно прекратиться из-за нарушений в синтезе соматомединов (считается, что это вещество по генетическим причинам не вырабатывается в печени пигмеев, имеющих во взрослом состоянии рост 7—10-летнего ребенка). Напротив, гиперсекреция гормона роста у детей (например, вследствие развития доброкачественной опухоли гипофиза) может привести к гигантизму. Если же гиперсекреция начинается после того, как под воздействием половых гормонов уже завершается окостенение хрящевых участков костей, формируется акромегалия — непропорционально удлиняются конечности, кисти и стопы, нос, подбородок и другие оконечные части тела, а также язык и пищеварительные органы. Нарушение эндокринной регуляции у больных акромегалией нередко ведет к различным заболеваниям обмена веществ, в том числе к развитию сахарного диабета. Своевременно примененная гормональная терапия или хирургическое вмешательство позволяют избежать наиболее опасного развития болезни.
Гормон роста начинает синтезироваться в гипофизе чело на 12-й неделе внутриутробной жизни, а после 30-й недели его концентрация в крови плода становится в 40 раз больше чем у взрослого. К моменту рождения концентрация гормона роста падает примерно в 10 раз, но все же остается чрезвычайно высокой. В период от 2 до 7 лет содержание гормона роста в крови детей сохраняется примерно на постоянном уровне, который в 2—3 раза превышает уровень взрослых. Показательно, что в этот же период завершаются наиболее бурные ростовые процессы до начала пубертата. Затем наступает период значительного уменьшения уровня гормона — и рост тормозится. Новое повышение уровня гормона роста у мальчиков отмечается после 13 лет, причем его максимум отмечается в 15 лет, т.е. как раз в момент наиболее интенсивного увеличения размеров тела у подростков. К 20 годам содержание гормона роста в крови устанавливается на типичном для взрослых уровне.
С началом полового созревания в регуляцию ростовых процессов активно включаются половые гормоны, стимулирующие анаболизм белков. Именно под действием андрогенов происходит соматическое превращение мальчика в мужчину, поскольку под влиянием этого гормона ускоряется рост костной и мышечной ткани. Повышение концентрации андрогенов во время полового созревания вызывает скачкообразное увеличение линейных размеров тела — происходит пубертатный скачок роста. Однако вслед за этим то же повышенное содержание андрогенов приводит к окостенению зон роста в длинных костях, в результате чего их дальнейший рост прекращается. В случае преждевременного полового созревания рост тела в длину может начаться чрезмерно рано, но рано и закончится, и в итоге мальчик останется «недомерком».
Андрогены стимулируют также усиленный рост мышц и хрящевых частей гортани, в результате чего у мальчиков «ломается» голос, он становится значительно более низким. Анаболическое действие андрогенов распространяется на все скелетные мышцы тела, благодаря чему мышцы у мужчин развиты гораздо больше, чем у женщин. Женские эстрогены обладают менее выраженным, чем андрогены, анаболическим действием. По этой причине у де-вочек в пубертатный период увеличение мышц и длины тела меньше, а пубертатный скачок роста слабее выражен, чем у мальчиков.
Гормональная регуляция полового созревания
Хромосомные наборы мужского и женского организма различаются тем, что у женщин имеется две Х-хромосомы, а у мужчин -~ одна Х- и одна Y-хромосома. Это различие определяет пол зародыша и возникает в момент оплодотворения. Уже в эмбриональном периоде развитие половой сферы полностью зависит от активности гормонов. Известно, что если гонада эмбриона не развивается или удалена, то формируются женские половые органы — яйцеводы и матка. Для того чтобы развились мужские половые органы, обходима гормональная стимуляция со стороны семенников. Яичник зародыша не является источником гормонального воздействия на развитие половых органов. Активность половых хромосом наблюдается на очень коротком отрезке онтогенеза — от 4-й до 6-й недели внутриутробного развития и проявляется только в активизации семенников. Никаких различий в дифференцировке других тканей тела между мальчиками и девочками нет, и если бы не гормональное влияние семенников, развитие протекало бы только по женскому типу.
Женский гипофиз работает циклически, что определяется гипоталамическими влияниями. У мужчин гипофиз функционирует равномерно. Установлено, что в самом гипофизе нет половых различий, они заключены в нервной ткани гипоталамуса и прилежащих ядер головного мозга. В период между 8-й и 12-й неделей внутриутробного развития семенник должен «сформировать» гипоталамус по мужскому типу с помощью андрогенов. Если этого не произойдет, у плода сохранится циклический тип секреции гонадотропинов даже при наличии мужского набора хромосом XY. Поэтому употребление беременной женщиной половых стероидов на начальных этапах беременности весьма опасно.
Мальчики рождаются с хорошо развитыми экскреторными клетками семенников (клетки Лейдига), которые, однако, деградируют на 2-й неделе после рождения. Вновь они начинают развиваться только в период полового созревания. Этот и некоторые другие факты позволяют предположить, что репродуктивная система человека в принципе готова к развитию уже к моменту рождения, однако под влиянием специфических нейрогуморальных факторов этот процесс затормаживается на несколько лет — до начала пубертатных перестроек в организме.
У новорожденных девочек иногда наблюдается реакция со стороны матки, появляются кровянистые выделения наподобие менструальных, а также отмечается активность молочных желез вплоть до секреции молока. Подобная же реакция молочных желез бывает и у новорожденных мальчиков.
В крови новорожденных мальчиков содержание мужского гордона тестостерона выше, чем у девочек, но уже через неделю после рождения ни у мальчиков, ни у девочек этого гормона почти не обнаруживают. Однако через месяц у мальчиков содержание тестостерона в крови вновь быстро увеличивается, достигая к 4~7 мес половины уровня взрослого мужчины, и сохраняется на таком уровне в течение 2—3 мес, после чего несколько снижается не меняется до начала пубертата. С чем связан такой инфантильный выброс тестостерона — неизвестно, но есть предположение, что в этот период формируются какие-то очень важные «мужские» свойства.
Процесс полового созревания протекает неравномерно, и его принято подразделять на определенные этапы, на каждом из которых складываются специфические взаимоотношения между системами нервной и эндокринной регуляцией. Эти этапы английский антрополог Дж. Таннер назвал стадиями, а исследовали отечественных и зарубежных физиологов и эндокринологов позволили установить, какие морфофункциональные свойства характерны для организма на каждой из этих стадий.
Нулевая стадия — стадия новорожденности. Эта стадия характеризуется наличием в организме ребенка сохранившихся материнских гормонов, а также постепенным регрессом деятельности собственных желез внутренней секреции, после того как родовой стресс закончится.
Первая стадия — стадия детства (инфантилизм). Период от года до появления первых признаков полового созревания расценивается как этап полового инфантилизма, т. е. подразумевается, что в этот период ничего не происходит. Однако незначительное и постепенное увеличение секреции гормонов гипофиза и гонад в этот период имеет место, и это косвенно свидетельствует о созревании диэнцефальных структур головного мозга. Развитие половых желез в этот период не происходит потому, что оно тормозится гонадотропин-ингибирующим фактором, который вырабатывается гипофизом под воздействием гипоталамуса и другой мозговой железы — эпифиза. Этот гормон очень похож на гонадотропный гормон по строению молекулы, а потому легко и прочно соединяется с рецепторами тех клеток, которые настроены на чувствительность к гонадотропинам. Однако никакого стимулирующего действия на половые железы гонадотропин-ингибирующий фактор не оказывает. Напротив, он перекрывает доступ к рецепторам гонадотропному гормону. Такая конкурентная регуляция — типичный прием, используемый в метаболических процессах всех живых организмов.
