Пределы взрываемости газовоздушных смесей. Физические свойства природных газов
Физические свойства природных газов. Основные газовые законы.
Природный газ бесцветен и не имеет запаха (в том случае, если не имеет в своём составе сероводорода), он легче воздуха. Горюч и взрывоопасен.
Основные свойства газов.
Удельный вес воздуха – 1,293 кг/ м. куб.
Природный газ метан СН4, удельный вес 0,7 кг/м.куб., легче воздуха в 1,85 раза, поэтому он скапливается в верхней части помещения или колодца.
Сжиженный газ пропан-бутановая смесь (пропан С3Н8, бутан С4Н10) имеет удельный вес в жидком состоянии 0,5 т/м.куб., в газообразном состоянии 2,2 кг/м.куб.
Теплотворная способность.
При полном сгорании одного кубического метра газа выделяется 8-8,5 тыс. килокалорий;
Сжиженный газ пропан-бутан 24-28 тыс. килокалорий
Температура горения газов +2100 градусов С.
Природный и сжиженный газы в смеси с воздухом взрывоопасны.
Пределы взрываемости газовоздушных смесей.
| Вид газа | Нижний предел взрываемости | Верхний предел взрываемости | Температура воспламенения |
| Метан СН4 | 5% | 15% | +645 градусов |
| Пропан-бутановая смесь | 1,5% | 9,5% | +500 градусов |
До 5% воспламенение не происходит
От 5% до 15% происходит взрыв
Свыше 15% если есть источник огня воспламенится и будет гореть
Источники воспламенения газовоздушной смеси
● открытый огонь(спички, папироса);
● Электрическая искра, возникающая при включении и выключении любого электроприбора;
● Искра, возникающая от трения инструмента о детали газового оборудования или при ударе металлических предметов друг о друга
Природный и сжиженные газы не имеют цвета и запаха. Для облегчения обнаружения утечки газа в него добавляют этилмеркаптан – вещество, имеющее характерный запах кислой капусты.
Одорант добавляют в природный газ – 16 грамм на 1 тыс. м.куб.
Сжиженный газ – 60-70 грамм на 1 тонну
Основные газовые законы.
Состояние газа определяется тремя его величинами: T температурой, P давлением и V объемом. Нормальными условиями принято считать температуру Т=0 по Цельсию, давление P= 101,325 кПа (атмосферное). При таких условиях приняты следующие обозначения: Vо – объём газа, а давление — через Pо.
Закон Бойля — Мариотта : при T= const давление газа обратно пропорционально объему газа:
Р2/Р1 = V1/V2 или PV = const.
Закон Гей - Люссака: при Р=const объем газа изменяется прямо пропорционально абсолютной температуре :
V1/T1 = V2/T2 или V/T = const.
При V=const давление газа изменяется прямо пропорционально абсолютной температуре:
Р1/Т1=P2/Т2.
Объединяя эти законы, получим универсальный газовый закон:
PV/T = P0V0/T0.
Это выражение допускает, при решении задач по химии, нахождение какого то одного параметра при известных остальных двух.
Следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объем.
В частности, при нормальных условиях, т.е. при 0° С (273К) и
101,3 кПа, объем 1 моля газа, равен 22,4 л. Этот объем называют молярным объемом газа Vm.
Таким образом, при нормальных условиях (н.у.) молярный объем любого газа Vm = 22,4 л/моль.
Закон Авогадро используется в расчетах для газообразных веществ. При пересчете объема газа от нормальных условий к любым иным используется объединенный газовый закон Бойля-Мариотта и Гей-Люссака:
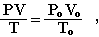
где Рo, Vo, Тo - давление, объем газа и температура при нормальных условиях (Рo = 101,3 кПа, Тo = 273К).
Если известна масса (m) или количество (n) газа и требуется вычислить его объем, или наоборот, используют уравнение Менделеева - Клапейрона:
PV = n RT,
где n = m/M - отношение массы вещества к его молярной массе,
R - универсальная газовая постоянная, равная 8,31 Дж/(мольЧК).
Из закона Авогадро вытекает еще одно важное следствие: отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов. Эта постоянная величина называется относительной плотностью газа и обозначается D. Так как молярные объемы всех газов одинаковы (1-е следствие закона Авогадро), то отношение молярных масс любой пары газов также равна этой постоянной:
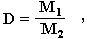
где М1 и М2 - молярные массы двух газообразных веществ.
Величина D определяется экспериментально как отношение масс одинаковых объемов исследуемого газа (М1) и эталонного газа с известной молекулярной массой (М2). По величинам D и М2 можно найти молярную массу исследуемого газа:
M1 = D Ч M2.
