Человек как специфический объект генетического анализа. Медико-генетическое консультирование и прогнозирование.
В настоящее время уже не требует доказательств утверждение, что практически
все реакции организма (нормальные и патологические) определяются
индивидуальным генотипическим фоном. Именно это – уникальность набора генов у
каждого человека – определяет широкое варьирование физиологических реакций в
группе людей в ответ на воздействие одного и того же фактора и может быть в
одной из причин клинического полиморфизма заболевания. Вместе с этим
многочисленными исследованиями показано, что для большинства заболеваний
генетические факторы выступают не столько в роли таких «статистов», сколько
являются этиологически значимыми, однако определяющими развитие
патологического действия лишь тогда, когда они действуют однонаправлено с
определенной совокупностью экзогенных, внешнесредовых факторов. Подобная
трактовка обосновывает взгляд на многие заболевания как на болезни с
наследственным предрасположением, или мультифакториальные заболевания,
являющиеся, таким образом, эффектом совместного действия генетических и
средовых факторов предрасположения.
По данным ВОЗ, болезни с наследственным предрасположением составляют более
90% в общем спектре патологии человека, и к их числу могут быть отнесены
практически все заболевания, за исключением «чисто» наследственных аномалий,
вызванных генными и хромосомными мутациями, а также травматических и
инфекционных болезней, хотя и в последнем случае выраженность реакций
организма в ответ на воздействие бактерий и вирусов в определенной мере
зависит от генотипа.
Мультифакториальные заболевания в настоящее время являются самой частойпричиной обращения в Медико-генетическую консультацию. Цель таких обращенийобычно заключается в желании консультирующихся узнать о прогнозе потомстваили прогнозе здоровья уже родившегося ребенка или взрослого.В настоящее время в медицинской кибернетики накоплено большое число алгоритми программ, реализующих тот или иной метод распознавания образов, итогомкоторых является построение правил принятия дифференциально-диагностическихрешений. Вычисли- тельные метода диагностики заболеваний и прогнозирования ихисходов все шире находят применение в медицинской практике.Одним из самых распространенных и достаточно широко апробированныхматематических немашинных методов вычислительной диагностики, лежащих воснове разработки диагностических таблиц, является алгоритм неоднороднойпоследовательной статистической процедуры распознавания (НПСП), вытекающей изметода Байеса и позволяющей осуществлять выбор одной из двух конкурирующихдиагностических гипотез при заранее намеченном уровне надежности. Этавычислительная процедура, основанная на применении так называемогопоследовательного анализа Вальда, подробно изложена в монографии Е.В.Гублера, в связи с чем ее освещение в рамках настоящего сообщения оказалосьнецелесообразным. Несмотря на то что разработка и проверка диагностическихтаблиц требуют длительного анализа, правомерность их применения в различныхобластях медицины показана целым рядом авторов. Будучи крайне простыми иудобными в употреблении, диагностические таблицы являются весьма надежными,т.е. обеспечивают минимальную вероятность ошибочного результата враспознавании дифференцируемых патологических состояний. Вместе с тем с точкизрения поставленной задачи представляет интерес возможность использованиятабличного метода для прогнозирования развития заболевания.Материалы и методыВыбор язвенной болезни как модели для разработки программы попрогнозированию мультифакториального заболевания был обусловлен, в первуюочередь, тем, что, как свидетельствовали полученные ранее данные, язвеннаяболезнь является в целом мультифакториальным заболеванием. Вместе с тем былоотмечено, что язвенная болезнь – неоднородное заболевание, в пределахкоторого с генетической точки зрения возможно выделение язвенной болезнижелудка и возрастных вариантов язвенной болезни 12-перстной кишки. По этойпричине оказалось нецелесообразным осуществлять исследование не на язвеннойболезни в целом, а на одной из ее форм – дуоденальной язве в силу того, вчастности, что эта последняя является более генетически отягощенным и болеераспространенным заболеванием по сравнению с язвой желудка. Выбор одной изформ, а не всего заболевания в целом при наличии его генетическойгетерогенности является необходимым условием подхода к отбору материала припостановке задачи прогнозирования мультифакториального заболевания.Методами исследования на предварительном этапе были: клинико –генеалогический метод и лабораторные биохимические методы по определениюсреди обследуемых лиц перечисленных выше генетических маркеров.Обработка и оценка диагностической информации включенных в анализ признаковдля разработки таблицы по идентификации лиц с наличием комплекса признаков,отражающего наследственное предрасположение к дуоденальной язве, на основномэтапе исследования проводились посредством неоднородной последовательнойстатистической процедуры.78.Мутации несовместимые с жизнью человека.
Летальные гены
Это гены, вызывающие гибель организма до достижения им половой зрелости. Летальные гены являются рецессивными. Вот несколько примеров проявления их влияния: "заячья губа"и "волчья пасть" - дефект развития верхней челюсти, гемофилия - отсутствие у крови способности свертываться, "рассасывание плодов"у внешне благополучной суки и т.д.
Полулетальные гены, например гены, определяющие двусторонний крипторхизм, в конечном счете, становятся летальными для породы в результате ее вымирания. Щенки с "волчьей пастью", если их не оперировали, не могут сосать и поэтому погибают. Серо-голубой с черным крапом окрас связан с полулетальным геном, и если он унаследован потомком от обоих родителей, то этот потомок может стать слепым, глухим или бесплодным. По этой причине двух собак такого окраса никогда не спаривают. Практически было бы лучше всего считать этот окрас дисквалифицирующим во всех породах.
79.Изменение геномной организации наследственного материала. Геномные мутации. Рассмотренные выше механизмы рекомбинации наследственного материала (кроссинговер, расхождение гомологичных хромосом и независимое поведение негомологичных хромосом в анафазе I мейоза, оплодотворение) при закономерном их течении обусловливают комбинативную изменчивость, но не изменяют общей структуры генома как видовой характеристики. Эволюционно сложившаяся у данного вида сбалансированность по дозам отдельных генов, распределение этих генов по группам сцепления остаются стабильной характеристикой генома каждого вида. Однако как на генном и хромосомном уровнях организации наследственного материала, так и на геномном уровне он способен приобретать мутационные изменения. Эти изменения могут использоваться как эволюционный материал. При этом ускоренные темпы эволюционного процесса, наблюдаемые на отдельных этапах исторического развития, как правило, бывают обусловлены не столько накоплением генных мутаций, сколько существенными изменениями структуры именно всего генома. К последним относятся изменения дозового соотношения различных генов и изменение состава групп сцепления внутри генома.Причиной структурных изменений генома может быть нарушение тех процессов, которые в норме обеспечивают его устойчивость, в первую очередь процессов, протекающих в мейозе.Так, нарушение кроссинговера, приводящее к обмену неравноценными участками ДНК между хроматидами, может привести к утрате или удвоению определенной нуклеотидной последовательности в них. Если это затрагивает структуру отдельного гена, то возможно возникновение генной мутации с изменением количества нуклеотидов в нем (см. разд. 3.4.2.3). Если при неравноценном обмене затронут участок хроматиды, содержащий несколько генов, изменяется доза этих генов в геноме. Он либо лишается каких-то генов (деления), либо эти гены оказываются в геноме в двойном количестве (дупликапия). Изменение дозового соотношения отдельных генов наблюдается также при разных видах хромосомных перестроек, не обязательно связанных с неравноценным кроссинговером (см. разд. 3.5.3.3).Нарушение расхождения бивалентов в анафазе I мейоза является причиной изменения количества хромосом в гаплоидном наборе гамет. Нерасхождение отдельного бивалента приводит к появлению одной гаметы, лишенной данной хромосомы, и другой, имеющей эту группу сцепления в двойном количестве (рис. 3.76). Оплодотворение таких гамет нормальными половыми клетками приводит к появлению особей, в кариотипе которых изменено общее число хромосом за счет уменьшения (моносомия) или увеличения (трисомия) числа отдельных хромосом. Нарушения структуры генома, заключающиеся в изменении количества отдельных хромосом, называют анэуплоидией.
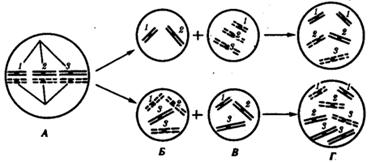
Рис. 3.76. Нарушение расхождения отдельных бивалентов (1, 2, 3) в мейозе как причина возникновения анэуплоидий:А — метафаза 1 мейоза; Б — образование аномальных гамет в результате нарушения расхождения 3-го бивалента в анафазе I мейоза; В — оплодотворение аномальных гамет нормальными гаметами другого пола; Г — образование зигот с анэуплоидным кариотипом (моносомия или трисомия по 3-й хромосоме, соответственно сверху и снизу)
В том случае, если в целом повреждается механизм распределения гомологичных хромосом между полюсами веретена (что наблюдается при его разрушении), клетка остается неразделившейся. Во второе деление мейоза она вступает не гаплоидной, а диплоидной. Из нее образуются диплоидные гаметы. Оплодотворение таких гамет приводит к образованию триплоидных организмов. Увеличение в кариотипе зиготы числа наборов хромосом называют полиплоидией.Такие структурные изменения наследственного материала довольно часто встречаются в природе у растений, что обеспечивает у них относительно быстрые темпы видообразования. Полиплоидизацию путем искусственного разрушения веретена деления с помощью колхицина широко применяют в селекции при выведении новых сортов растений.Структурные изменения генома могут выражаться в ином распределении генов по группам сцепления. Когда отдельные хромосомы соединяются по типу робертсоновской транслокации или, наоборот, из одной хромосомы образуются две самостоятельные, это ведет к изменению числа групп сцепления в геноме (см. разд. 3.5.3.3). При реципрокных транслокациях между негомологичными хромосомами или при инверсиях изменяется место положения отдельных генов, что нередко сказывается на характере их функционирования (эффект положения).Любые мутационные изменения в наследственном материале гамет —генеративные мутации —становятся достоянием следующего поколения, если такие гаметы участвуют в оплодотворении. Поэтому отклонения в течении митоза или мейоза в клетках-предшественницах гамет имеют большое эволюционное значение. Если же мутации любого ранга (генные, хромосомные или геномные) возникают в соматических клетках — соматические мутации — они передаются только потомкам этих клеток, т.е. не выходят за пределы данного организма. Исключение составляют соматические мутации, возникшие в клетках органов вегетативного размножения, от которых они передаются новому поколению организмов. Одной из причин соматических мутаций являются патологические митозы. При нарушении нормального течения митоза (нерасхождение хроматид отдельных хромосом, многополюсные митозы и т.д.) дочерние клетки получают аномальную наследственную программу и их дальнейшее развитие отклоняется от нормы. Патологические митозы часто наблюдаются в клетках злокачественных опухолей.Таким образом, несмотря на существование механизмов, обеспечивающих стабильность структуры генома, на этом уровне организации наследственного материала могут появляться эволюционно значимые изменения. Они способны обеспечить достаточно резкий скачок в ходе исторического развития живой природы.
80.Причины гетероплоидии у человека.
Гетероплоидия (анеуплоидия) — явление, при кбтором клетки организма содержат измененное число хромосом, не кратное гаплоидному набору. Формы, имеющие дополнительные хромосомы, называются полисомиками. Форма 2п +1 — трисомик, так как одна хромосома повторена трижды. Форма 2п — 1 — моносомик, так как одна хромосома представлена в единственном числе. Форма 2n -2- асомик (нуллисомик), так как отсутствует пара гомологичных хромосом.
Добавление и утрата одной хромосомы могут быть одновременно в двух и более парах: 2n+1 + 1 -двойной трисомик, 2n- 1 — 1 -двойной моносомик и т. д.
Гетероплоидные клетки могут появляться в результате нарушений мейоза или митоза. Например, нерасхождение пары хромосом (АН) в мейозе приводит к образованию. При участии таких гамет в оплодотворении появятся гетероплоидные формы 2п-А. Добавление или утрата одной хромосомы вызывает значительные изменения фенотипа, благодаря которым можно установить влияние отдельных хромосом и генов, в них локализованных, на проявление определенных свойств и признаков организма. Анеуплоиды встречаются как у растений и животных, так и у человека. Анеуплоидные растения обладают низкой жизнеспособностью и плодовитостью. Однако анеуплоидные формы, в частности моносомики, имеют практическое значение, так как используются в генетической инженерии для направленного «конструирования» определенных генотипов путем введения желательных генов, а также в селекции при замещении Х-хромосом для улучшения сорта растений. Путем замещения отдельных хромосом получены новые формы пшеницы, устойчивые к ржавчине и другим заболеваниям.
У человека также встречаются случаи гетероплоидии, которые вызывают хромосомные болезни.
81.Изменения нуклеотидных последовательностей ДНК. Генные мутации.
Мутации по типу замены азотистых оснований. Эти мутации происходят в силу ряда конкретных причин. Одной из них может быть возникающее случайно или под влиянием конкретных химических агентов изменение структуры основания, уже включенного в спираль ДНК. Если такая измененная форма основания остается не замеченной ферментами репарации, то при ближайшем цикле репликации она может присоединять к себе другой нуклеотид. Примером может служить дезаминирование цитозина, превращающегося в урацил самопроизвольно или под влиянием азотистой кислоты (рис. 3.18). Образующийся при этом урацил, не замеченный ферментом ДНК-гликозилазой, при репликации соединяется с аденином, который впоследствии присоединяет тимидиловый нуклеотид. В результате пара Ц—Г замещается в ДНК парой Т—А (рис. 3.19, I). Дезаминирование метилированного цитозина превращает его в тимин (см. рис. 3.18). Тимидиловый нуклеотид, являясь естественным компонентом ДНК, не обнаруживается ферментами репарации как изменение и при следующей репликации присоединяет адениловый нуклеотид. В результате вместо пары Ц—Г в молекуле ДНК также появляется пара Т—А.
Другой причиной замены оснований может быть ошибочное включение в синтезируемую цепь ДНК нуклеотида, несущего химически измененную форму основания или его аналог. Если эта ошибка остается не замеченной ферментами репликации и репарации, измененное основание включается в процесс репликации, что нередко приводит к замене одной пары на другую. Примером этого может служить присоединение в ходе репликации к аденину материнской цепи нуклеотида с 5-бромурацилом (5-БУ), аналогичного тимидиловому нуклеотиду. При последующей репликации 5-БУ охотнее присоединяет к себе не аденин, а гуанин. Гуанин в ходе дальнейшего удвоения образует комплементарную пару с цитозином. В итоге пара А—Т заменяется в молекуле ДНК парой Г—Ц . Из приведенных примеров видно, что изменения структуры молекулы ДНК по типу замены оснований возникают либо до, либо в процессе репликации первоначально в одной полинуклеотидной цепи. Если такие изменения не исправляются в ходе репарации, то при последующей репликации они становятся достоянием обеих цепей ДНК.
82.Изменение структурной организации хромосом. Хромосомные мутации.
Генные (точковые) мутации - это изменения числа и/или последовательности нуклеотидов в структуре ДНК (вставки, выпадения, перемещения, замещения нуклеотидов) в пределах отдельных генов, приводящие к изменению количества или качества соответствующих белковых продуктов.
Замены оснований приводят к появлению трех типов мутантных кодонов: с измененным смыслом (миссенс-мутации), с неизмененным смыслом (нейтральные мутации) и бессмысленных, или терминирующих кодонов (нонсенс-мутации).
В результате миссенс-мутании в кодируемом данным геном полипептиде одна аминокислота замещается на другую, поэтому фенотипическое проявление мутации зависит от функциональной значимости затронутого домена. Так замены аминокислот в активных центрах белков могут сопровождаться полной потерей их функциональной активности. К примеру, миссенс-мутация в 553-м кодоне гена FAC, приводящая к замене лейцина на пролин, делает продукт этого гена неспособным комплементировать функциональный дефект в клетках больных анемией Фанкони.
Не всякая замена аминокислоты отразится на функциональной активности белка, вследствие чего происшедшая мутация может остаться не вьшвленной. Этим объясняется факт отмечаемого несовпадения частоты мутаций в определенном гене и встречаемости мутантов по нему. Кроме того, в силу вырожденности генетического кода, не всякая замена основания приведет к миссенс-мутации, возможно, она окажется нейтральной. В результате нонсенс мутации кодон, определяющий какую-либо аминокислоту, превращается в один из стоп-кодонов, не транслирующихся на рибосомах (UAA UAG, UGA). Появление такого кодона не в конце структурного гена, а внутри него, приводит к преждевременной терминации трансляции и обрыву полипептидной цепи. Нонсенс-мутации обладают наибольшим повреждающим действием, так как образующиеся при преждевременной терминации трансляции белки не способны к модификации, часто не защищены от действия протеолитических ферментов и быстро деградируют.
Вставки, перемещения или выпадения отдельных оснований или их коротких последовательностей в пределах гена вызывают сдвиг рамки считывания. Природа таких мутаций была изучена при анализе аминокислотной последовательности белков фага Т4, кодируемьгх геном дикого типа е+ и тремя разными мутантными генами е, содержащими взаимно супрессирующие фреймшифт (сдвигающие рамку считывания)-мутации. Оказалось, что некоторые единичные мутации являются следствием одновременных изменений нескольких соседних нуклеотидов. И, скорее всего, единичная мутация со сдвигом рамки возникает в результате вставки двух соседних нуклеотидов, а не одного. При возникновении мутаций со сдвигом рамки считывания меняются все триплеты ниже сайта дупликации или делеиии по ходу считывания, при этом повышается вероятность возникновения стоп-кодонов и, соответственно, терминации трансляции.
С точки зрения структурно-функциональной организации генов, происходящие внутри них замены, вставки, выпадения, перемещения нуклеотидов можно объединить в следующие группы:
1) мутации в регуляторных областях генов
• мутации в промоторной части (например, регуляторном элементе с последовательностью PuCPuCCC и внутри ТАТА-бокса у гена р-глобина) снижают уровень синтеза белкового продукта;
• мутации в сайте полиаденилирования снижают уровень транскрипции (характерно для афроамериканцев, страдающих талассемией; подробно о гемоглобинопатиях см. часть П Медицинская генетика).
Таким образом, мутации в регуляторных 5' и 3'-нетранслируемых областях генов вызывают количественные изменения соответствующих продуктов и проявляются фенотипически (клинически) в зависимости от порогового уровня белков, при котором их функция еще сохраняется;
2) мутации в кодирующих областях генов
• мутации в экзонах могут приводить к преждевременному окончанию белкового синтеза. Именно это происходит, к примеру, в случае 6-талассемии: в результате мутаций внутри экзона гена гемоглобина белковая цепь оказывается укороченной и не обладает активностью;
• мутации в интронах способны генерировать новые сайты сплайсинга, которые, конкурируя с нормальными (исходными), в итоге, заменяют их. Возникновение замен в гене гемоглобина, замедляющих сплайсинг, известно и для В0-, и для В+-талассемии.
• мутации в сайтах сплайсинга (на стыках экзонов и нитронов), нарушают процессинг первичного РНК-транскрипта и приводят к трансляции бессмысленных белков: удлиненного при неправильном вырезании интронов либо укороченного при вырезании экзонов. Так, в результате одиночных замен в донорском участке сплайсинга гена гемоглобина процессинг нарушается, что приводит к развитию В0- или р+-талассемии. А мутация сдвига рамки считывания в акцепторном участке сплайсинга гена ХРА приводит к полной инактивации белка и, как следствие, к развитию тяжелой формы пигментной ксеродермы.
Замены нуклеотидов в кодирующих областях генов, не сопровождающиеся заменами аминокислот в силу вырожденности генетического кода, приводят к нейтральным мутациям, не оказывающим заметного влияния ни на функцию соответствующего белка, ни на его структуру.
83.Методы в генетике человека. Генеалогический метод. Принципы построения родословных и их типы.
Генеалогический метод, Популяционный метод., Близнецовый метод. Цитологический метод, Биохимический метод.
Генеалогический метод заключается в анализе родословных и позволяет определить тип наследования (доминантный
рецессивный, аутосомный или сцепленный с полом) признака, а также его моногенность или полигенность. На основе полученных сведений прогнозируют вероятность проявления изучаемого признака в потомстве, что имеет большое значение для предупреждения наследственных заболеваний.
При аутосомном наследовании признак характеризуется равной вероятностью проявления у лиц обоих полов. Различают аутосомно-доминантное и аутосомно-рецессивное наследование.
При аутосомно-доминантном наследовании доминантный аллель реализуется в признак как в гомозиготном, так и в гетерозиготном состоянии. При наличии хотя бы у одного родителя доминантного признака последний с разной вероятностью проявляется во всех последующих поколениях. Однако для доминантных мутаций характерна низкая пенетрантность. В ряде случаев это создает определенные трудности для определения типа наследования.
При аутосомно-рецессивном наследовании рецессивный аллель реализуется в признак в гомозиготном состоянии. Рецессивные заболевания у детей встречаются чаще при браках между фенотипически нормальными гетерозиготными родителями. У гетерозиготных родителей (Аа х Аа) вероятность рождения больных детей (аа) составит 25%, такой же процент (25%) буду здоровы (АА), остальные 50% (Аа) будут также здоровы, но окажутся гетерозиготными носителями рецессивного аллеля. В родословной при аутосомно-рецессивном наследовании заболевание может проявляться через одно или несколько поколений.
Интересно отметить, что частота появления рецессивного потомства значительно повышается при близкородственных браках, так как концентрация гетерозиготного носительства у родственников значительно превышает таковую в общей массе населения.
Сцепленное с полом , наследование характеризуется, как правило, неравной частотой встречаемости признака у индивидуумов разного пола и зависит от локализации соответствующего гена в Х- или Y-хромосоме. В X- и Y-хромосомах человека имеются гомологичные участки, содержащие парные гены. Гены, локализованные в гомологичных участках, наследуются так же, как и любые другие гены, расположенные в аутосомах. По-видимому, негомологичные гены имеются и в Y-хромосоме. Они передаются от отца к сыну и
проявляются только у мужчин (голандрический тип наследования) .
У человека в Y-хромосоме находится ген, обусловливающий дифференцировку пола. В Х-хромосоме имеется два негомологичных участка, содержащих около 150 генов, которым нет аллельных в Y-хромосоме. Поэтому вероятность проявления рецессивного аллеля у мальчиков более высока, чем у девочек. По генам, локализованным в половых хромосомах, женщина может быть гомозиготной или гетерозиготной. Мужчина, имеющий только одну Х-хромосому, будет гемизиготным по генам, которым нет аллелей в Y-хромосоме.
Наследование, сцепленное с Х-хромосомой, может быть доминантным и рецессивным ( чаще рецессивным). Рассмотрим Х - сцепленное рецесивное наследование на примере такого заболевания селовека, как гемофилия ( нарушениесвертывания крови). Известный всему мипу пример: носитель гемофилии королева Виктория была гетерозиготной и передала мутантный ген сыну Леопольду и двум дочерям. Эта болезнь проникла в ряд королевских домов Европы и попала в Россию.
84.Методы в генетике человека. Цитогенетические методы. Кариотип человека.
Генеалогический метод, Популяционный метод., Близнецовый метод. Цитологический метод, Биохимический метод.
Цитогенетические методы исследования применяют для диагностики хромосомных болезней. Они включают:
· исследования полового хроматина - определение Х- и Y-хроматина;
· кариотипирование (кариотип - совокупность хромосом клетки) - определение количества и структуры хромосом с целью диагностики хромосомных болезней (геномных мутаций и хромосомных аберраций).
